Secretaría de Políticas, Regulación e Institutos
y
Secretaría de Agricultura, Ganadería, Pesca y Alimentos
CODIGO ALIMENTARIO ARGENTINO
Resolución Conjunta 118/2008 y 474/2008
Modificación.
Bs.
As., 10/6/2008
VISTO
la Ley 18.284, los Artículos 1363 y 1381 del Decreto Nº 2126 de fecha 30 de
junio de 1971 y el expediente Nº 1-0047-2110-5387-06-3 del Registro de la Administración Nacional de Medicamentos, Alimentos y Tecnología Medica; y
CONSIDERANDO:
Que
a fin de actualizar los valores de Ingesta Diaria Recomendada (IDR) de
proteínas, vitaminas y minerales para los individuos de los distintos grupos
poblacionales tomando como referencia las últimas recomendaciones de: Human
Vitamin and Mineral Requirements, FAO/OMS, 2002 y Dietary Reference Intake,
Food and Nutrition Broad, Institute of Medicine, Nacional Academies Press,
2002-2005., resulta necesario modificar las previsiones de los artículos 1363 y
1381 —Capítulo XVII del Código Alimentario Argentino—.
Que
dichas modificaciones serán de utilidad para el diseño, formulación y rotulado
de productos alimenticios destinados a personas con trastornos metabólicos
específicos y/o condiciones fisiológicas particulares, que no se encuentran
alcanzados por la Resolución GMC Nº 46/03 - "Reglamento Técnico MERCOSUR
sobre el Rotulado Nutricional de Alimentos Envasados".
Que
la Comisión Nacional de Alimentos ha intervenido, expidiéndose favorablemente.
Que
los Servicios Jurídicos Permanentes de los Organismos involucrados han tomado
la intervención de su competencia.
Que
se actúa en virtud de las facultades conferidas por el Decreto Nº 815/99.
Por
ello,
EL
SECRETARIO DE POLITICAS, REGULACION E INSTITUTOS
Y
EL
SECRETARIO DE AGRICULTURA, GANADERIA, PESCA Y ALIMENTOS
RESUELVEN:
Artículo 1º —
Incorpórase al Código Alimentario Argentino el artículo 1387, el que quedará
redactado de la siguiente manera:
"Artículo
1387: Las siguientes tablas serán utilizadas para el diseño, formulación y
rotulado de productos alimenticios destinados a personas con trastornos
metabólicos específicos y/o condiciones fisiológicas particulares, que no se
encuentren alcanzados por la Resolución GMC Nº 46/03 – Reglamento Técnico
MERCOSUR sobre Rotulado Nutricional de Alimentos Envasados o sus
modificatorias.
Cuando
un alimento no esté formulado para un género específico, se utilizarán los
valores de Ingesta Diaria Recomendada (IDR) correspondientes a los hombres.
Estas
tablas podrán ser complementadas para el caso de poblaciones específicas no
contempladas por la presente Resolución, debiendo ser las mismas determinadas
por la Autoridad Sanitaria Nacional.
Tabla
I: Ingesta Diaria Recomendada de Proteína, Vitaminas y Minerales para Adultos
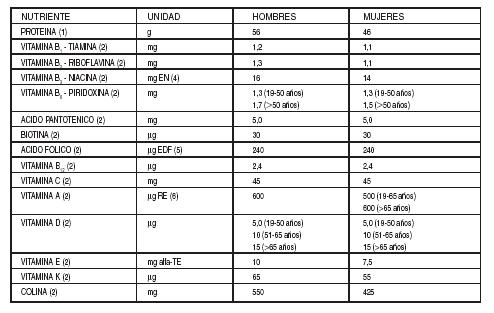
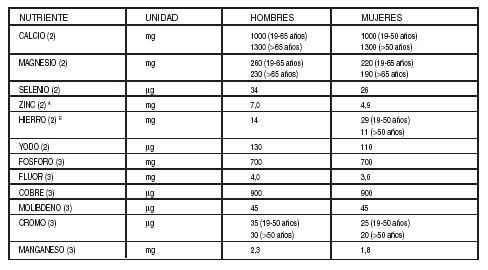
Tabla
II: Ingesta Diaria Recomendada de Proteína, Vitaminas y Minerales para Mujeres
Embarazadas o en Período de Lactancia
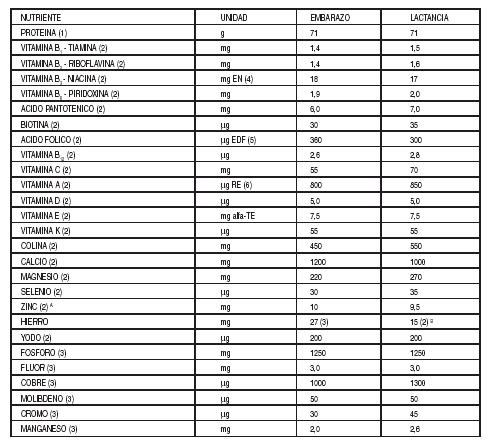
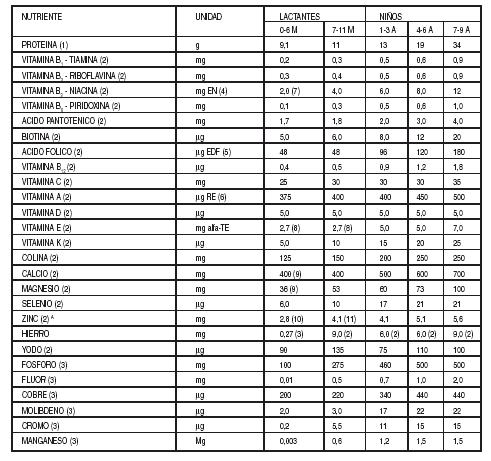
(1) Dietary Reference Intakes for Energy, Carbohydrate. Fiber,
Fat, Fatty Acids, Cholesterol, Protein, and Amino Acids. Food and Nutrition
Board, Institute of Medicine, National Academies Press, 2002/2005.
(2) Human Vitamin and Mineral Requirements, FAO/WHO, 2002.
(3) Dietary Reference Intakes (DRIs): Recommended Intakes
for Individuals, Elements. Food and Nutrition Board, Institute of Medicine,
National Academies Press, 2004.
(4)
EN = equivalente de niacina, factor de conversión de triptófano a niacina 60 a 1.
(5)
EDF = equivalente dietario de folato; µg de EDF provistos = [µg de folato
proveniente de los alimentos +(1,7 x µg de ácido fólico sintético)].
(6)
Ingestas seguras recomendadas como mcg RE/día; 1 mcg retinol = 1 mcg RE; 1 mcg
b-caroteno = 0,167 mcg RE; 1 mcg de otros carotenoides provitamina A = 0,084
mcg RE.
(7)
Niacina preformada.
(8)
Los sustitutos de leche materna no deberían contener menos de 0,3 mg de
equivalentes de a-tocoferol (TE)/100 ml de producto reconstituido, ni menos de
0,4 mg TE/g PUFA. El contenido de vitamina E de la leche materna humana, 2,7 mg
por 850 ml de leche, es bastante constante.
(09)
Fórmula infantil.
(10)
Para niños alimentados con fórmulas infantiles.
(11)
No aplicable a niños que consumen únicamente leche humana.
(A)
Moderada biodisponibilidad.
(B)
10% de biodisponibilidad.
Art. 2º —
Sustitúyase el artículo 1363 el cual quedará redactado de la siguiente manera:
"Se entiende por Alimentos Fortificados aquellos alimentos en los cuales
la proporción de proteínas y/o aminoácidos y/o vitaminas y/o substancias
minerales y/o ácidos grasos esenciales es superior a la del contenido natural
medio del alimento corriente, por haber sido suplementado significativamente.
La
porción del alimento fortificado deberá aportar entre un:
1.
20% y 50% para vitaminas liposolubles y minerales
2.
20% y 100% para vitaminas hidrosolubles
de
los Requerimientos Diarios Recomendados establecidos en las Tablas del anexo A
de la Resolución Conjunta 149-2005 SPRRS y 683-2005 SAGPyA: Valores Diarios de
Referencia de nutrientes (VDR) de declaración obligatoria y Valores de Ingesta
Diaria Recomendada de nutrientes (IDR) de declaración voluntaria: vitaminas y
minerales o algunas de las tablas mencionadas en el Art. 1367 cuando se trate
de un alimento para grupos poblacionales específicos no contemplados por la Res. GMC 46/03.
Los
nutrientes incorporados deberán:
a)
Ser estables en el alimento en las condiciones habituales de almacenamiento,
distribución, expendio y consumo y presentar una adecuada biodisponibilidad.
b)
No presentar incompatibilidad con ninguno de los componentes del alimento ni
con otro nutriente agregado.
c)
Estar presente en niveles tales que no ocasionen una ingesta excesiva por
efecto acumulativo a partir de otras fuentes de la dieta.
No
se autorizará la fortificación de las siguientes clases de alimentos: cárneos y
productos derivados, helados, alimentos azucarados —Capítulo X— (excepto los
que contengan jugo en su composición), bebidas analcohólicas o polvos para
prepararlas (excepto en ambos casos que contengan jugo en su composición),
aguas, aguas carbonatadas, aguas minerales, con o sin gas.
La
denominación de venta de los alimentos fortificados será "…fortificado(a)
con…". En el primer espacio en blanco se indicará la denominación de venta
del alimento correspondiente sin fortificar y en el segundo espacio en blanco
el (los) nutriente(s) con que se ha fortificado el alimento. En la tabla de
información nutricional o debajo de ella se indicará la ingesta diaria
recomendada del alimento, el grupo etario que se adoptó como referencia y el
porcentaje de la ingesta diaria recomendada del (de los) nutriente(s) que cubre
la ingesta recomendada del alimento.
Art. 3º —
Sustitúyase el artículo 1381 el cual quedará redactado de la siguiente manera:
"Suplementos Dietarios
1-
Incorpórense los Suplementos Dietarios al Registro Nacional Unico (R.N.U.) de
Productos, en el que quedarán registradas las autorizaciones de
comercialización de tales productos otorgadas por la autoridad competente.
Establécese que sólo se inscribirán en el Registro Nacional Unico (R.N.U.) de
Productos, los Suplementos Dietarios que respondan a la definición establecida
en el punto 2 del presente artículo.
2-
Se definen como Suplementos Dietarios a los productos destinados a incrementar
la ingesta dietaria habitual, suplementando la incorporación de nutrientes en
la dieta de las personas sanas que, no encontrándose en condiciones
patológicas, presenten necesidades básicas dietarias no satisfechas o mayores a
las habituales. Siendo su administración por vía oral, deben presentarse en
formas sólidas (comprimidos, cápsulas, granulado, polvos u otras) o líquidas
(gotas, solución, u otras), u otras formas para absorción gastrointestinal,
contenidas en envases que garanticen la calidad y estabilidad de los productos.
Podrán
contener en forma simple o combinada: péptidos, proteínas, lípidos, lípidos de
origen marino, aminoácidos, glúcidos o carbohidratos, vitaminas, minerales,
fibras dietarias y hierbas con las limitaciones indicadas en el punto 3, todos
en concentraciones tales que no tengan indicación terapéutica o sean aplicables
a estados patológicos.
Los
Suplementos Dietarios de lípidos marinos estarán constituidos por un aceite
aislado o mezcla de aceite de peces u otros organismos marinos.
En
el caso de estar constituidos por triglicéridos de peces u otros organismos
marinos, deberán presentar un contenido de ácido eicosapentaenoico (EPA) y de
ácido decosahexaenoico (DHA) no menores de 6% cada uno y cuando se encuentren
constituidos por concentrados de triglicéridos de aceite de pescado u otros
organismos marinos, deberán presentar un contenido de ácido eicosapentaenoico
(EPA) y de ácido cocosa hexaenoico (DHA) no menores de 15 y 10%
respectivamente.
El
aceite de germen de prímula, familia de las onagráceas (Oenothera biennis)
deberá responder a las siguientes exigencias:
-
Apariencia: De amarillo claro o amarillo verdoso, libre de materiales extraños
e inmiscible con el agua.
-
Sabor o color: Característico del aceite, sabor y olor suave, sin indicios de
rancidez u otra anormalidad en los ensayos organolépticos.
-
Densidad a 20 °C: 0,915 - 0,930 g/ml.
-
Indice de peróxido: No más de 10 mEq 02/Kg de aceite.
-
Indice de acidez: No más de 10 mg KOH/Kg de aceite.
-
Solvente residual: No más de 1 ppm (Hexano).
-
Indice de iodo: 150 - 160.
-
Humedad: No más de 0,1%.
Los
límites máximos de tolerancia de contaminantes inorgánicos serán los
establecidos en el presente Código.
No
se autorizarán suplementos dietarios que contengan Triptofano agregado en su
formulación.
3-
Las hierbas, que no se encuentren descriptas en este Código, y se soliciten
como ingredientes de suplementos dietarios deberán ser previamente aprobadas
por la Autoridad Sanitaria Nacional.
4-
Defínese como Ingesta Diaria de Referencia (IDR) al nivel de ingesta diaria que
es suficiente para satisfacer los requerimientos de los nutrientes de casi
todos los individuos de un grupo. Los nutrientes propuestos para suplementar la
dieta deberán proveer no menos del 20% de la IDR de acuerdo a los valores que figuran en las Tablas del Artículo 1387.
5-
Defínanse como Niveles de No Observación de Efectos Adversos (NOEA) a la
ingesta máxima de determinado nutriente no asociada con efectos adversos. Los
valores establecidos son los que figuran en la siguiente tabla que se
transcribe a continuación:
NIVELES
DE NO OBSERVACION DE EFECTOS ADVERSOS (NOEA)
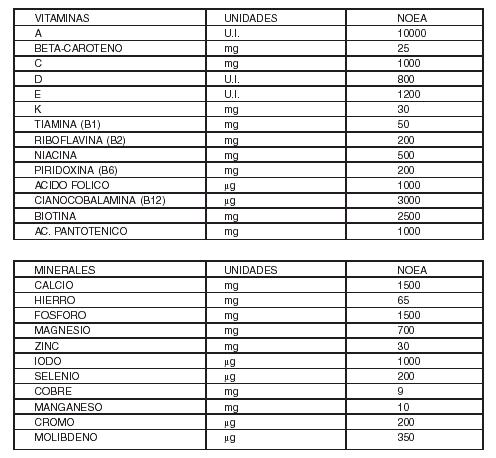
Los
suplementos dietarios para embarazadas, lactancia y niños no podrán superar los
límites establecidos en la Tabla II: Ingesta Diaria Recomendada de Proteína,
Vitaminas y Minerales para Mujeres Embarazadas o en Período de Lactancia, del
artículo 1387.
6-
Establécese que no se inscribirán en el Registro Nacional Unico (R.N.U.) de
Productos, los Suplementos Dietarios que contengan nutrientes cuyos valores de
ingesta diaria superen los niveles establecidos en el punto anterior, aun
cuando no se les atribuyan indicaciones terapéuticas.
7-
En el rótulo de todos los suplementos dietarios se consignarán asimismo las
leyendas:
-
"Consulte a su médico antes de consumir este producto".
-
"No utilizar en caso de embarazo, lactancia ni en niños", salvo en
aquellos productos que sean específicos para estos casos.
-
"Mantener fuera del alcance de los niños".
-
En el caso que superen los valores de IDR en el rótulo deberá consignarse la
siguiente advertencia:
"Supera
la ingesta diaria de referencia" en los nutrientes que correspondan.
a)
En caso de suplementos dietarios que contengan en su composición Vitaminas
Liposolubles (A, D, E, y/o K) en cantidad superior a la IDR en el rótulo deberá consignarse la siguiente advertencia:
"Este
producto puede provocar efectos tóxicos por acumulación de vitaminas
liposolubles (A, D, E, y/o K); no vuelva a consumirlo sin consultar a su
médico".
b)
En caso de contener en su composición Hierro en cantidad superior a la IDR deberá consignar la siguiente advertencia:
"Este
producto contiene Hierro y debe ser consumido únicamente por individuos sanos,
antes de consumirlo consulte a su médico".
c)
En caso de contener en su composición Glúcidos deberá consignar la siguiente
advertencia:
"Este
producto no debe ser utilizado por diabéticos"
d)
En caso de contener en su composición Cromo deberá consignar la siguiente
advertencia:
"Diabéticos:
este producto contiene cromo. Consulte a su médico".
e)
En el caso de contener en su composición Ingredientes de Alto Valor Calórico deberá
consignar la siguiente advertencia:
"Este
producto está indicado para personas que realizan una actividad física que
requiere un aporte de calorías diarias superior al promedio de la población
(2000 cal/día). Su consumo debe realizarse bajo estricto control médico".
f)
En el caso de contener en su composición Fenilalanina o Aspartamo deberá
consignarse la siguiente advertencia:
"Contiene
fenilalanina: contraindicado para fenilceturónicos" u otra similar.
El
texto de todas las advertencias deberá tener caracteres de buen realce y
visibilidad.
En
ningún caso deberá figurar la expresión "Venta Libre".
8-
El rótulo de los suplementos dietarios deberá cumplir los requisitos
establecidos en este Código detallando la información nutricional, consignando
el nombre de los nutrientes, sus contenidos por unidad o porción y el
porcentaje de la IDR para cada uno de ellos de acuerdo a los valores
establecidos en las Tablas del artículo 1387.
Las
hierbas deberán declararse en el listado de ingredientes mediante su denominación
común, denominación botánica y mencionando la parte somática de la planta
utilizada.
Asimismo
deberá figurar la fecha de vencimiento del producto, las condiciones de
almacenamiento del mismo y de corresponder, la forma de conservación una vez
abierto el envase.
9-
En el rótulo, como en la publicidad de los suplementos dietarios no deberán
figurar indicaciones terapéuticas atribuibles a los mismos. Asimismo no deberán
incluirse en los mismos afirmaciones que no estén demostradas científicamente
y/o que puedan inducir a error en cuanto a las propiedades del producto.
10-
El sobrerrótulo (rótulo complementario), de los suplementos dietarios
importados deberá estar escrito en idioma español; el tamaño de la letra
utilizada deberá garantizar su lectura, sin necesidad de instrumentos ópticos
por personas de visión normal o corregida. No deberá contener textos que
contravengan lo establecido en los incisos precedentes.
11-
A los efectos de la elaboración, importación y/o, exportación de los
Suplementos Dietarios se deberá solicitar previamente la inscripción en el
Registro ante la Autoridad Sanitaria competente, cumplimentando los requisitos
de información y documentación correspondiente.
12-
Para la obtención de la autorización mencionada en el inciso precedente, sin
perjuicio de los requisitos que la Autoridad Competente determine, se evaluará y aprobará el rótulo y sobrerrótulo de cada
producto. A tal fin se exigirá la presentación del proyecto de rótulo redactado
de acuerdo a lo establecido en los puntos 7 a 10 del presente artículo.
13-
El material de promoción o publicidad del suplemento dietario que tenga
tránsito federal, cualquiera fuera el medio empleado para su difusión, deberá
estar autorizado previamente por la Autoridad Sanitaria Nacional. El contenido de la publicidad no podrá modificar la información
de los rótulos aprobados. En el caso de incluirse en la publicidad información
adicional que, por razones de espacio no estuviese incluida en el rótulo, la
misma deberá estar avalada por trabajos científicos internacionales.
14-
Para los productos a ser importados se define como evidencia de
comercialización, la documentación probatoria autorizando el consumo del
Suplemento Dietario en el mercado interno del país de origen. A los efectos del
cumplimiento del presente inciso será aceptado únicamente el Certificado de
Libre Venta expedido por el organismo gubernamental competente del país
invocado.
15-
Las autorizaciones de comercialización de los Suplementos Dietarios tendrán una
validez de cinco (5) años. Sin perjuicio de ello, la Autoridad Sanitaria Nacional podrá disponer la prohibición de venta de tales productos cuando
razones de orden científico-técnico permitan concluir que su consumo resulta
perjudicial para la salud de la población.
16-
El titular del producto será solidariamente responsable, con el Director
Técnico del establecimiento, del cumplimiento de lo establecido en el presente
artículo."
Art. 4º —
Toda modificación en la rotulación de los alimentos en virtud de la presente
Resolución será de cumplimiento obligatorio por parte de los elaboradores no
siendo exigible presentación alguna ante cualquier Autoridad Sanitaria.
Art. 5º —
La presente Resolución entrará en vigencia a partir del día siguiente al de su
publicación en el Boletín Oficial, otorgándosele a las empresas un plazo de 90
(NOVENTA) días para la adecuación de rótulos y 90 (NOVENTA) días adicionales
para el agotamiento de stock de los mismos.
Art. 6º —
Regístrese, comuníquese a quienes corresponda. Dése a la Dirección Nacional del Registro Oficial para su publicación. Cumplido, archívese. — Carlos A.
Soratti. — Javier M. de Urquiza.