Disposición
3598/2002
Adóptanse los
Criterios Básicos de Categorización de Establecimientos Asistenciales,
incluidos en la Resolución del ex Ministerio de Salud y Acción Social Nº
282/94, en relación con la presentación de la Declaración Jurada del
Investigador Principal de los Centros de Estudios de
Bioequivalencia/Biodisponibilidad.
Bs. As., 8/8/2002
VISTO las Leyes nros.
16.463 y 24.766, los Decretos Nº 9763/64, Nº 150/92 y sus modificatorios Nº
1890/ 92 y Nº 177/93 y normas complementarias, Resolución Conjunta del ex M.S. y
A.S. Nº 988/92 y el ex M.E. y O. Y S.P. Nº 748/92 y la Disposiciones A.N.M.A.T.
Nº 5330/96 y 3185/99, y
CONSIDERANDO:
Que las prescripciones
legales y reglamentarias citadas en el VISTO de la presente constituyen la
normativa aplicable al registro, fiscalización y control de medicamentos y
especialidades medicinales y a las actividades de elaboración, fraccionamiento,
pescripción, expendio, comercialización, importación y exportación de dichos
productos.
Que la aplicación de las
normativas aludidas tiene como finalidad última la protección de la salud de la
población, mediante la adopción de un modelo fiscalizador de gestión que sin
perjuicio de la lectura objetiva de la información calificada, destine los
mayores esfuerzos a la verificación continua de la eficacia, seguridad y
calidad de los productos que aquélla consume.
Que estando los estudios
de bioequivalencia comprendidos dentro de la metodología de la farmacología
clínica, los mismos deben cumplir con las Buenas Prácticas de Investigación
Clínica.
Que por Disposición
A.N.M.A.T. 3185/99 se aprobaron recomendaciones para la realización de estudios
de bioequivalencia entre medicamentos con riesgo sanitario significativo y se
estableció un cronograma de implementación gradual en consideración a los
antecedentes internacionales en la materia.
Que los estudios de
biodisponibilidad/bioequivalencia deben ser realizados en centros que cuenten
con recursos humanos, físicos y materiales adecuados a la metodología de los
estudios de farmacocinética clínica.
Que deviene necesario
normatizar los requisitos indispensables y necesarios que deben cumplir los
centros en que se realicen estudios de farmacocinética clínica.
Que en el marco de la
normatización mencionada, el investigador principal deberá suscribir una
declaración jurada para facilitar la corroboración de dicha información en las
inspecciones que se realicen en el centro.
Que a los efectos de la
categorización de los establecimientos asistenciales en los que se desarrollen
los estudios de biodisponibilidad/bioequivalencia se aplicarán los criterios
establecidos en la Res. ex M.S.A.S. Nº 282/94.
Que la Comisión
"ad-honorem" de la A.N.M.A.T. en temas de
biodisponibilidad/bioequivalencia y la Dirección de Asuntos Jurídicos han
tomado la intervención de su competencia.
Que se actúa en virtud de
las facultades conferidas por el Decreto Nº 1490/92 y el Decreto Nº 197/92.
Por ello,
EL INTERVENTOR DE LA
ADMINISTRACION NACIONAL DE MEDICAMENTOS, ALIMENTOS Y TECNOLOGIA MEDICA
DISPONE:
Artículo 1º — Apruébase el
Formulario de Declaración Jurada del Investigador Principal de los Centros de
Estudios de Bioequivalencia/Biodisponibilidad cuyo formulario se adjunta como
Anexo I y que forma parte integrante de la presente.
Art. 2º — A los efectos de
la aplicación de la presente disposición, adóptanse los Criterios Básicos de
Categorización de Establecimientos Asistenciales, establecidos en la Resolución
del ex –Ministerio de Salud y Acción Social Nº 282/94.
Art. 3º — Establécese que
los centros asistenciales en los que se realicen estudios de biodisponibilidad/
bioequivalencia, deberán funcionar en establecimientos con categorías I, II o
III, de acuerdo a lo establecido por la Resolución Ministerial citada en el
Artículo 2º de la presente.
Art. 4º— Establécese que
el formulario aprobado en el Artículo 1º de la presente debidamente completado
y firmado deberá adjuntarse al formulario ECLIN, como trámite necesario para la
aprobación del ensayo clínico en el marco normativo de la Disposición
A.N.M.A.T. 5330/97.
Art. 5º — Regístrese,
comuníquese a CAEME, CILFA, COOPERALA, CAPGEN, AMAIFA, A.M.A., COMRA, COFA,
SAFYBI, Universidad de Buenos Aires: Facultad de Medicina, de Odontología, de
Farmacia y Bioquímica y a la Secretaría de Salud del Gobierno de la Ciudad de
Buenos Aires. Dése a la Dirección Nacional del Registro Oficial para su
publicación. Cumplido, archívese PERMANENTE. — Manuel R. Limeres.
ANEXO I
Declaración Jurada del
Investigador Principal del Centro de Estudios de
Biodisponibilidad/Bioequivalencia
|
Protocolo Nº:
|
|
Patrocinante:
|
|
Título del Protocolo:
|
|
|
|
Nombre del Centro:
|
|
Dirección:
|
|
Código Postal:
|
País:
|
Localidad/Provincia
|
|
Teléfono:
|
Fax:
|
E-mail:
|
Nivel del Establecimiento:
I, II, III, según Res. Ex-M.S. y A.S. Nº 282/94
Investigador Principal:
Título Profesional y
Matrícula habilitante:
Marque el casillero
correspondiente a SI / NO. Use el casillero de OBSERVACIONES para incluir
aclaraciones sobre el ítem evaluado, si el espacio es insuficiente continúe en
hoja aparte.
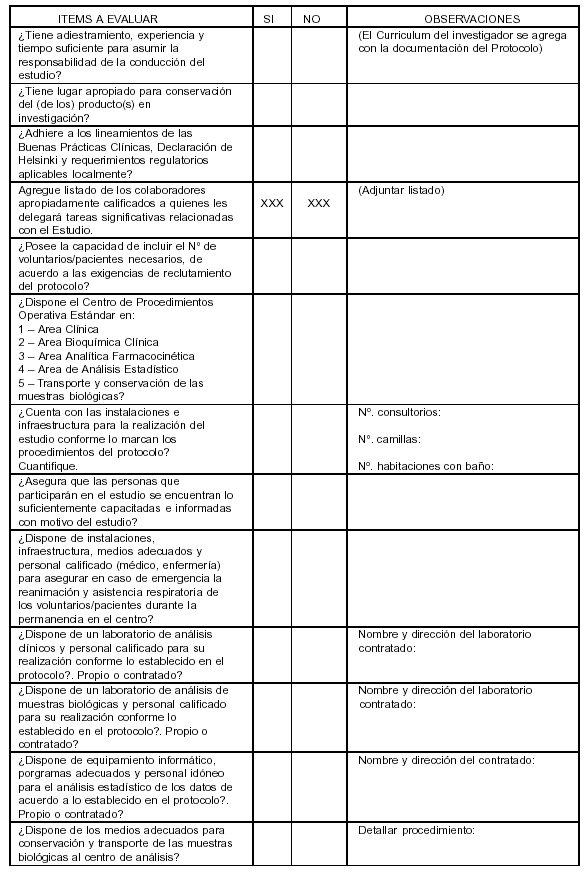
El que suscribe,
.............................................. en su carácter de investigador
principal, asume la responsabilidad máxima de este Centro de Estudios de
Biodisponibilidad/Bioequivalencia y afirma que los datos consignados en esta
declaración jurada son correctos y responden a la realidad del mismo.
|
———————————
|
————————————
|
———————————
|
|
Firma y Sello
|
Lugar
|
Fecha
|