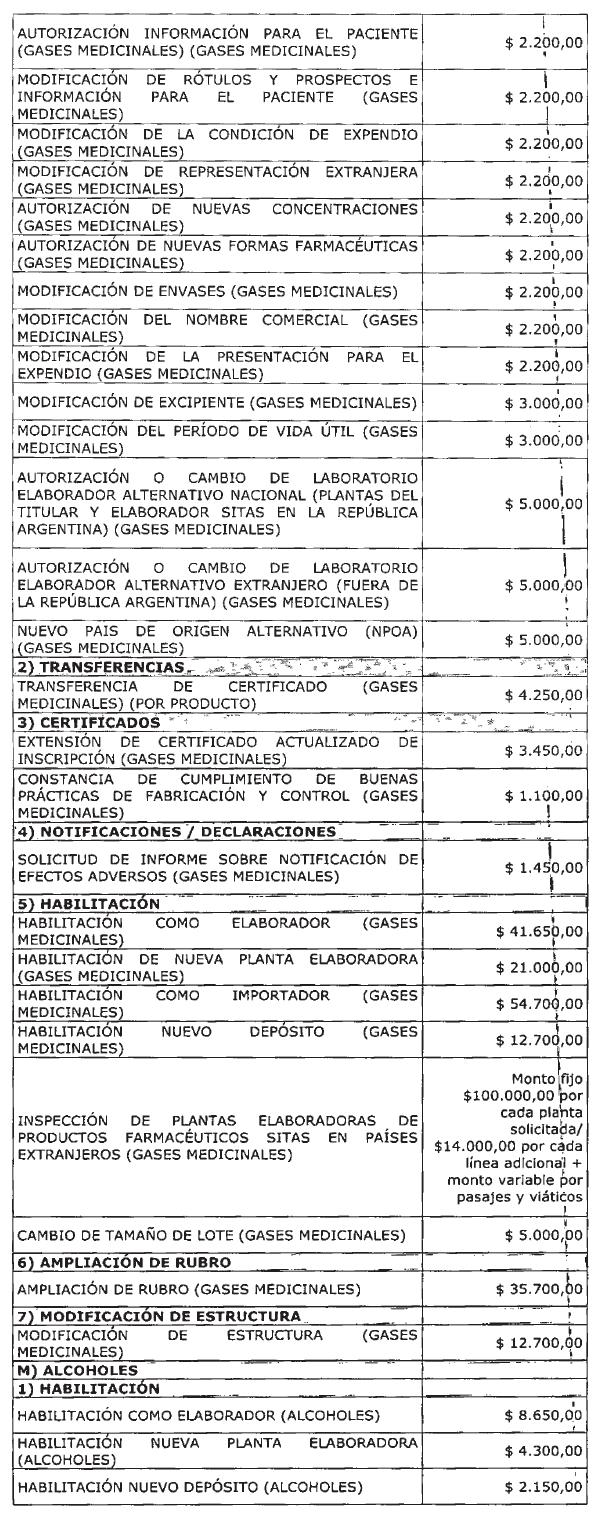
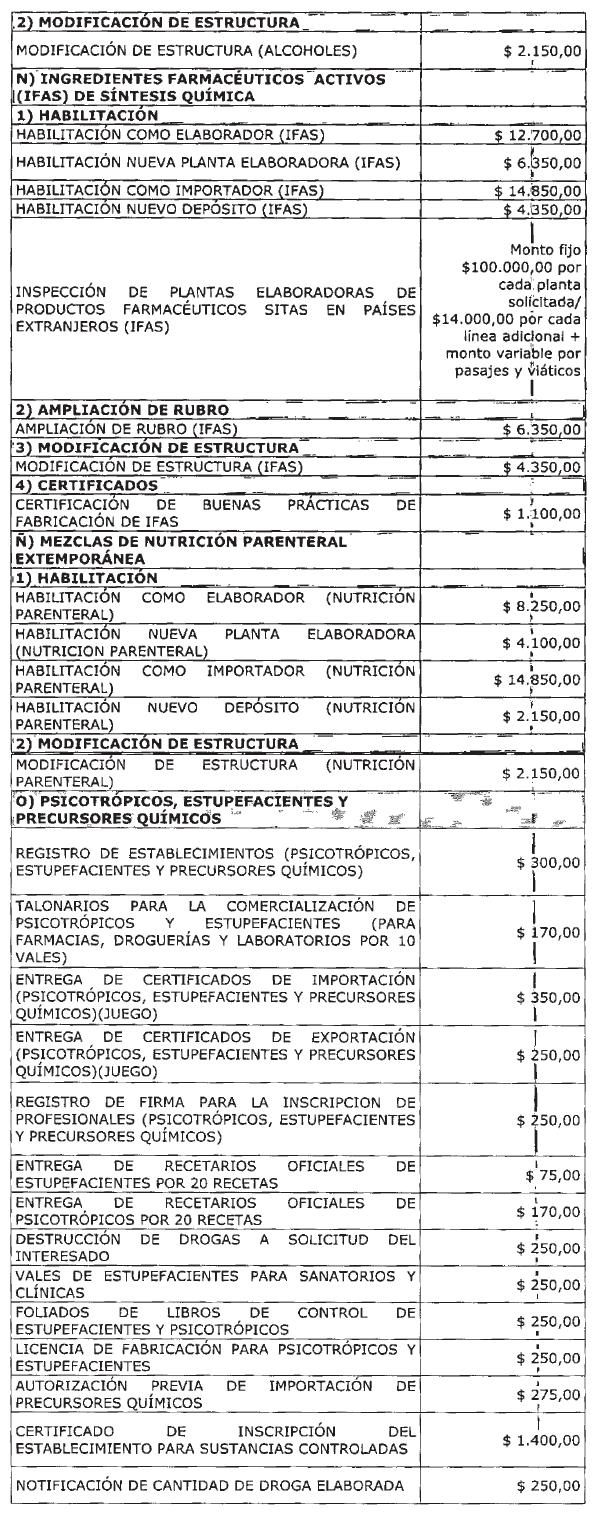
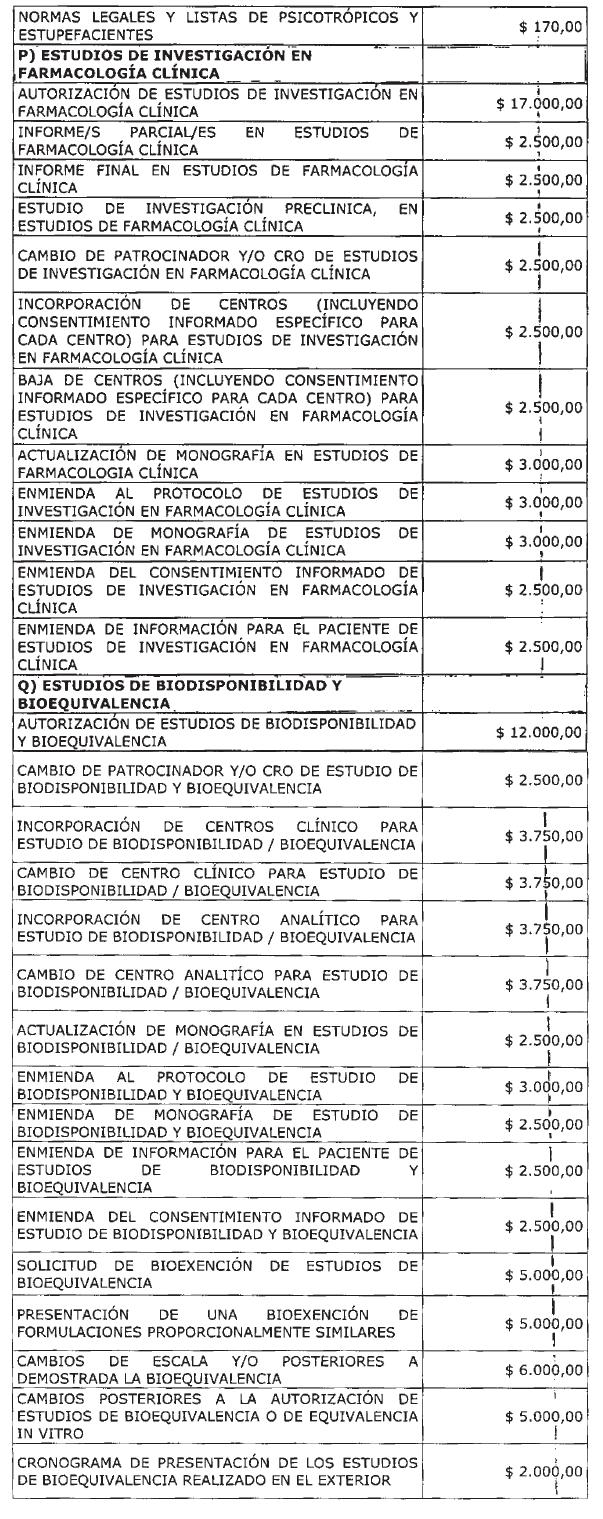
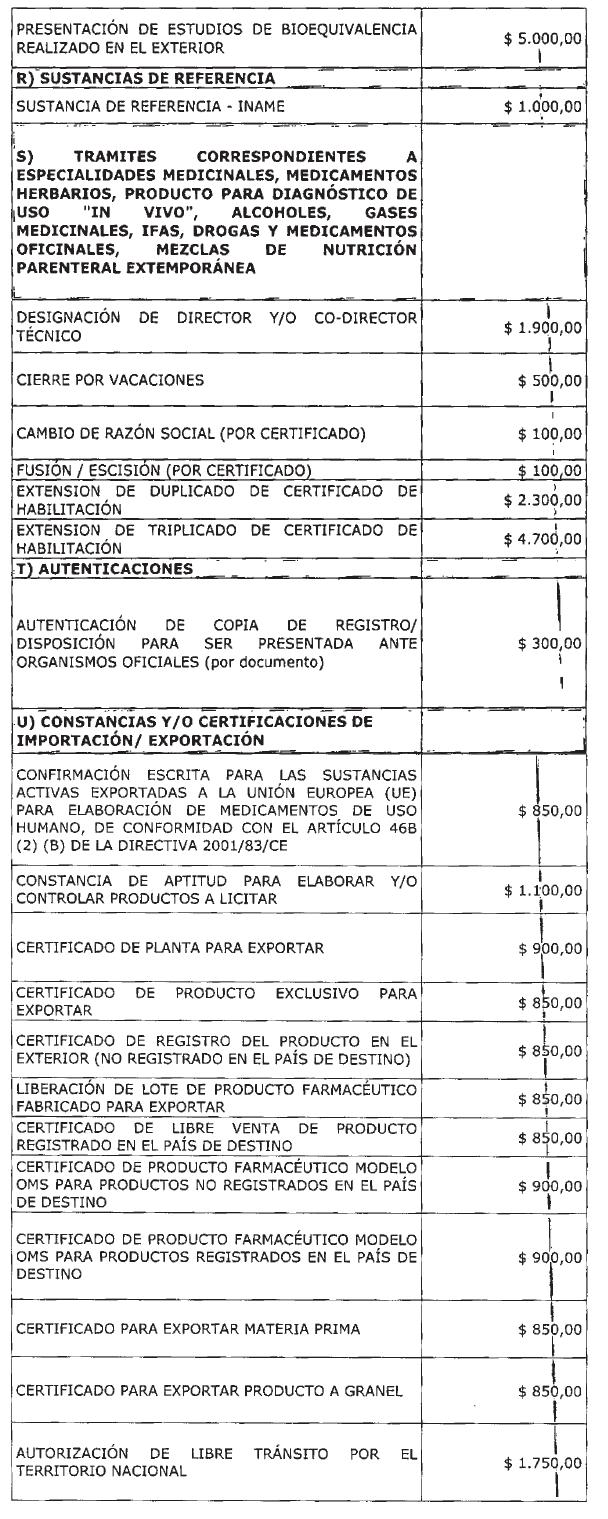
Disposición
6171/2015
Modifícanse los
montos de los aranceles que devengarán las tramitaciones que se realicen ante
la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica
correspondientes a especialidades medicinales, medicamentos herbarios,
productos para diagnóstico de uso “in vivo”, drogas y medicamentos oficinales,
vacunas, gases medicinales, alcoholes, ingredientes farmacéuticos activos
(IFAS) de síntesis química, mezclas de nutrición parenteral extemporánea,
psicotrópicos, estupefacientes y precursores químicos, estudios de
investigación en farmacología clínica, estudios de biodisponibilidad y
bioequivalencia, sustancias de referencia, autenticaciones y constancias y/o
certificaciones de importación/exportación conforme el detalle que, como Anexo,
forma parte integrante de la presente disposición.
Bs. As., 04/08/2015
VISTO las Disposiciones
ANMAT Nros. 871/14 y 7115/14, y el Expediente N° 1-47-0000-016330/14-1 del
Registro de esta Administración Nacional de Medicamentos, Alimentos y
Tecnología Médica (ANMAT); y
CONSIDERANDO:
Que por Decreto N° 1490/92
se creó esta Administración Nacional de Medicamentos, Alimentos y Tecnología
Médica (ANMAT) como organismo descentralizado de la Administración Pública
Nacional, con un régimen de autarquía económica y financiera, con jurisdicción
en todo el territorio de la Nación.
Que el aludido decreto
declaró de interés nacional las acciones dirigidas a la prevención, resguardo y
atención de la salud de la población que se desarrollen a través del control y
fiscalización de la calidad y sanidad, entre otros, de los productos,
sustancias, elementos y materiales que se consumen o utilizan en la medicina
humana y del contralor de las actividades, procesos y tecnologías que mediaren
o estuvieren comprendidos en dichas materias.
Que asimismo el artículo
3° del aludido decreto establece que esta Administración Nacional tendrá
competencia en todo lo referido al control y la fiscalización sobre la sanidad
y calidad, entre otros productos, de las drogas, productos químicos, reactivos,
formas farmacéuticas, medicamentos, elementos de diagnóstico y todo otro
producto de uso y aplicación en medicina humana.
Que por otra parte el
artículo 80, inc. m) del Decreto N° 1490/92 otorga a esta Administración
Nacional la atribución de determinar y percibir los aranceles y tasas
retributivas correspondientes a los trámites y registros que se efectúen, como
así también por los servicios que se presten.
Que asimismo, de
conformidad con lo establecido en el artículo 11 del referido cuerpo normativo,
esta Administración Nacional dispone para el desarrollo de sus acciones de los
recursos allí enumerados, entre los que se encuentran incluidos los
provenientes de las tasas y aranceles que aplique conforme a las disposiciones
adoptadas, los recargos establecidos por la mora en el pago de las tasas,
multas y aranceles que perciba y todo otro tipo de recurso que se determine a
través de las leyes y disposiciones que se establezcan con tal finalidad.
Que los aranceles que esta
Administración Nacional percibe actualmente por los servicios que presta
respecto de los trámites relacionados con especialidades medicinales, estudios
de investigación en farmacología clínica, estudios clínicos de
biodisponibilidad y bioequivalencia, gases medicinales, vacunas, medicamentos
herbarios, psicotrópicos y estupefacientes, productos para diagnóstico de uso
“In Vivo”, sustancias de referencia, ingredientes farmacéuticos activos (IFAS)
de síntesis química, drogas y medicamentos oficinales, mezclas de nutrición
parenteral extemporánea, alcoholes y certificado de libre sanción se encuentran
previstos en el Anexo de la Disposición ANMAT N° 871/14, rectificada por
Disposición ANMAT N° 7115/14.
Que los referidos montos
han devenido insuficientes para llevar a cabo de manera eficiente las tareas
correspondientes, cuya complejidad y especificidad se incrementan con el
permanente avance científico y tecnológico producido en el sector.
Que asimismo diversas
tramitaciones relacionadas con los productos sujetos a la fiscalización de esta
Administración Nacional han adquirido significancia en cuanto a su variedad y
especialidad, además de haberse incrementado considerablemente en su cantidad,
por lo que resulta conveniente determinar aranceles específicos para los
servicios que se prestan en relación con los aludidos trámites.
Que en consecuencia y
sobre la base de las sugerencias efectuadas por las áreas técnicas pertinentes
resulta necesario establecer los aranceles correspondientes a los siguientes
trámites: TESTIMONIO DE INSCRIPCIÓN EN EL REM (TESTIMONIO DE EXPORTACIÓN)
(constancias y/o certificaciones de importación y exportación); CAMBIO DE
CATEGORÍA A MEDICAMENTO HERBARIO (medicamentos herbarios); AUTORIZACIÓN DE
LIBERACIÓN DE LOTES (vacunas); AUTORIZACIÓN INFORMACIÓN PARA EL PACIENTE (especialidades
medicinales, medicamentos herbarios, productos para diagnóstico de uso “in
vivo”, vacunas, gases medicinales); CAMBIO DE CEPA (vacunas); CAMBIO DE TAMAÑO
DE LOTE (especialidades medicinales, medicamentos herbarios, vacunas, productos
para diagnóstico de uso “in vivo”, gases medicinales); HABILITACIÓN NUEVO
LABORATORIO DE CONTROL DE CALIDAD (especialidades medicinales, medicamentos
herbarios); REGISTRO DE ESTABLECIMIENTOS (psicotrópicos, estupefacientes y
precursores químicos); CAMBIO DE PATROCINADOR Y/O CRO (estudios de
investigación en farmacología clínica, estudios de biodisponibilidad y
bioequivalencia); ACTUALIZACIÓN DE MONOGRAFÍA (estudios de biodisponibilidad y
bioequivalencia); CRONOGRAMA DE PRESENTACIÓN DE LOS ESTUDIOS DE BIOEQUIVALENCIA
REALIZADO EN EL EXTERIOR (estudios de biodisponibilidad y bioequivalencia);
HABILITACIÓN DE NUEVA PLANTA ELABORADORA (especialidades medicinales,
medicamentos herbarios, productos para diagnóstico de uso “in vivo”, drogas y
medicamentos oficinales, gases medicinales, alcoholes, ingredientes
farmacéuticos activos (IFAS) de síntesis química, mezclas de nutrición
parenteral extemporánea); AUTORIZACIÓN DE COMERCIALIZACIÓN DE PRIMER LOTE
(medicamentos herbarios, vacunas); MODIFICACIÓN DE RÓTULOS Y PROSPECTOS E INFORMACIÓN
PARA EL PACIENTE (productos para diagnóstico de uso “in vivo”, gases
medicinales); MODIFICACIÓN DE LA CONDICIÓN DE EXPENDIO (medicamentos herbarios,
productos para diagnóstico de uso “in vivo”, vacunas, gases medicinales);
AUTORIZACIÓN DE NUEVAS CONCENTRACIONES (medicamentos herbarios, productos para
diagnóstico de uso “in vivo”, vacunas, gases medicinales); AUTORIZACIÓN DE
NUEVAS FORMAS FARMACÉUTICAS (medicamentos herbarios, productos para diagnóstico
de uso “in vivo”, vacunas, gases medicinales); MODIFICACIÓN DE REPRESENTACIÓN
EXTRANJERA (gases medicinales); MODIFICACIÓN DE LA DENOMINACIÓN DE LA FORMA
FARMACÉUTICA (especialidades medicinales, medicamentos herbarios, productos
para diagnóstico de uso “in vivo”, vacunas); MODIFICACIÓN EN LA FÓRMULA
(especialidades medicinales, medicamentos herbarios); MODIFICACIÓN DE LAS
CONDICIONES DE CONSERVACIÓN (especialidades medicinales, medicamentos
herbarios, productos para diagnóstico de uso “in vivo”, vacunas); MODIFICACIÓN
EN LA DENOMINACIÓN DEL PRINCIPIO ACTIVO (especialidades medicinales,
medicamentos herbarios); MODIFICACIÓN DE ENVASES (especialidades medicinales,
medicamentos herbarios, productos para diagnóstico de uso “in vivo”, vacunas,
gases medicinales); MODIFICACIÓN DEL NOMBRE COMERCIAL (especialidades
medicinales, medicamentos herbarios, productos para diagnóstico de uso “in
vivo”, vacunas, gases medicinales); MODIFICACIÓN DE LA PRESENTACIÓN PARA EL
EXPENDIO (medicamentos herbarios, productos para diagnóstico de uso “in vivo”,
vacunas, gases medicinales); MODIFICACIÓN DE EXCIPIENTE (especialidades
medicinales, medicamentos herbarios, productos para diagnóstico de uso “in
vivo”, vacunas, gases medicinales); MODIFICACIÓN DEL PERÍODO DE VIDA ÚTIL
(especialidades medicinales, medicamentos herbarios, productos para diagnóstico
de uso “in vivo”, vacunas, gases medicinales); UNIFICACIÓN DE CERTIFICADOS
(medicamentos herbarios, vacunas); SOLICITUD DE INFORME SOBRE NOTIFICACIÓN DE
EFECTOS ADVERSOS (medicamentos herbarios, productos para diagnóstico de uso “in
vivo”, gases medicinales); HABILITACIÓN COMO IMPORTADOR (mezclas de nutrición
parenteral extemporánea); HABILITACIÓN DE NUEVO DEPÓSITO (mezclas de nutrición
parenteral extemporánea); HABILITACIÓN COMO ACONDICIONADOR (medicamentos
herbarios); INSPECCIÓN DE PLANTAS ELABORADORAS DE PRODUCTOS FARMACÉUTICOS SITAS
EN PAÍSES EXTRANJEROS (productos para diagnóstico de uso “in vivo”,
ingredientes farmacéuticos activos (IFAS) de síntesis química, medicamentos
herbarios); HABILITACIÓN DE LABORATORIOS PARA LA ELABORACIÓN EN TERCEROS EN EL
PAÍS (medicamentos herbarios); AUTORIZACIÓN O CAMBIO DE LABORATORIO ELABORADOR
ALTERNATIVO NACIONAL (PLANTAS DEL TITULAR Y ELABORADOR SITAS EN LA REPÚBLICA
ARGENTINA) (especialidades medicinales, medicamentos herbarios, productos diagnóstico
de uso “in vivo”, vacunas, gases medicinales); AUTORIZACIÓN O CAMBIO DE
LABORATORIO ELABORADOR ALTERNATIVO EXTRANJERO (FUERA DE LA REPÚBLICA ARGENTINA)
(especialidades medicinales, medicamentos herbarios, productos diagnóstico de
uso “in vivo”, vacunas, gases medicinales) y NUEVO PAÍS DE ORIGEN ALTERNATIVO
(NPOA) (especialidades medicinales, medicamentos herbarios, productos
diagnóstico de uso “in vivo”, vacunas, gases medicinales).
Que por otra parte ha
devenido habitual la solicitud de autenticación de copias de documentos
emitidos por esta Administración Nacional para su presentación ante otros
organismos oficiales, lo cual torna procedente establecer un arancel específico
a tal fin.
Que asimismo el trámite de
cambio de razón social y de fusión/ escisión importa no sólo el dictado del
acto administrativo de toma de conocimiento del referido cambio o de la
fusión/escisión sino también su atestación en cada uno de los certificados de
titularidad de la empresa de que se trate, lo que implica un incremento
considerable en el empleo de recursos humanos destinados a ello, por lo cual
resulta procedente establecer, para el trámite en cuestión, el pago de un
arancel por cada certificado del que la empresa solicitante fuera titular.
Que por otra parte razones
de equidad ameritan fijar para los despachos de importación un arancel acorde
al monto de la importación.
Que finalmente resulta
conveniente suprimir los ítems Extensión de Duplicado de Certificado de
Inscripción en el REM/ Extensión de Duplicado de de Certificado y Extensión de
Triplicado de Certificado de Inscripción en el REM/Extensión de Triplicado de
Certificado, previstos en la Disposición ANMAT N° 871/14, y reemplazarlos por
el ítem EXTENSIÓN DE CERTIFICADO ACTUALIZADO DE INSCRIPCIÓN para los rubros
especialidades medicinales, medicamentos herbarios, productos para diagnóstico
de uso “In Vivo”, vacunas y gases Medicinales.
Que en virtud de todo lo
expuesto deviene necesario modificar los montos de los aranceles vigentes respecto
de los servicios prestados por esta Administración Nacional, así como también
crear nuevos aranceles, de acuerdo con lo señalado precedentemente, fijándolos
en un valor acorde con la excelencia en la calidad que requiere la
fiscalización de las industrias involucradas.
Que el Instituto Nacional
de Medicamentos, la Dirección de Gestión de Información Técnica y la Dirección
General de Administración han tomado la intervención de su competencia.
Que la Dirección General
de Asuntos Jurídicos ha tomado la intervención de su competencia.
Que se actúa en virtud de
las facultades conferidas por el Decreto N° 1490/92 y el Decreto N° 1886/14.
Por ello,
EL ADMINISTRADOR NACIONAL
DE LA ADMINISTRACIÓN NACIONAL DE MEDICAMENTOS, ALIMENTOS Y TECNOLOGÍA MÉDICA
DISPONE:
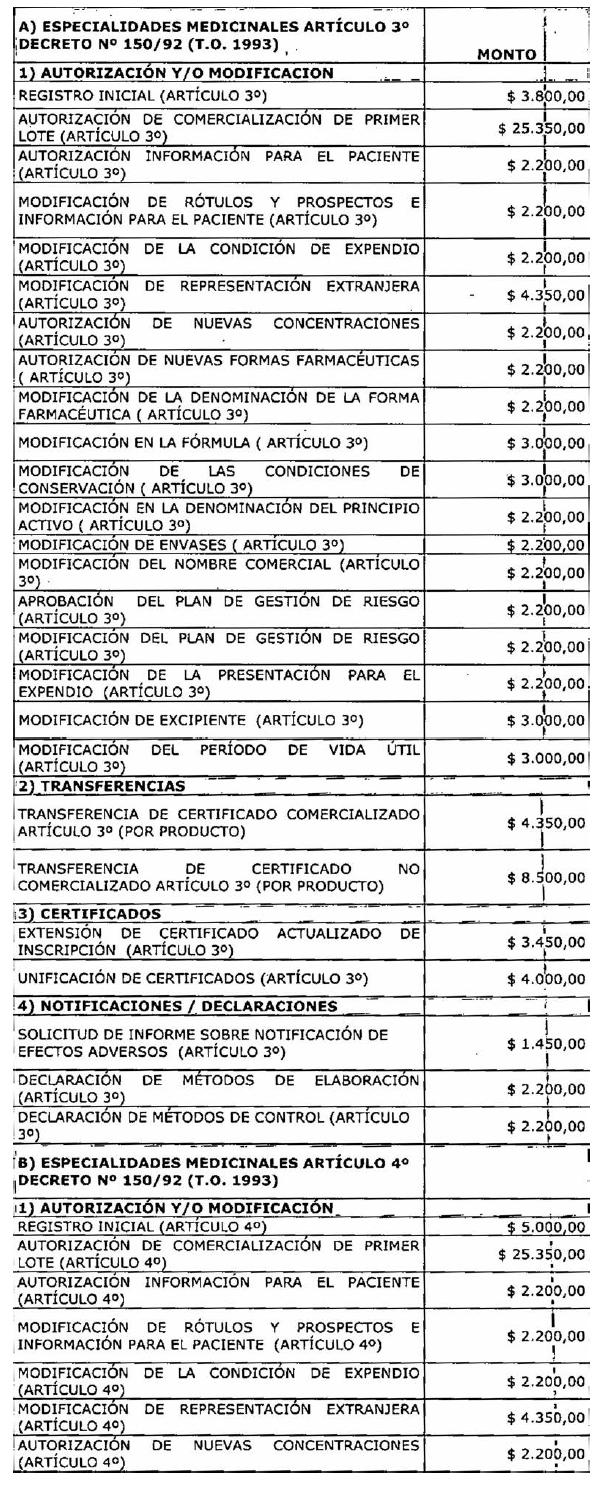
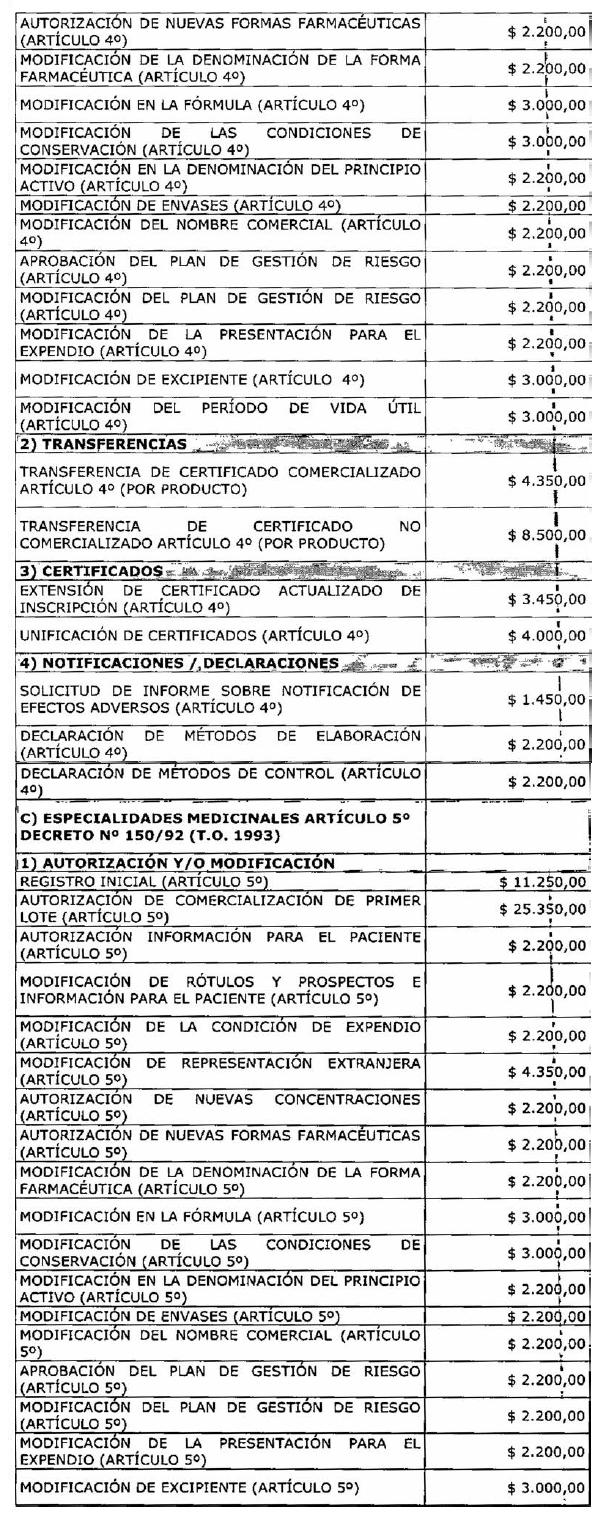
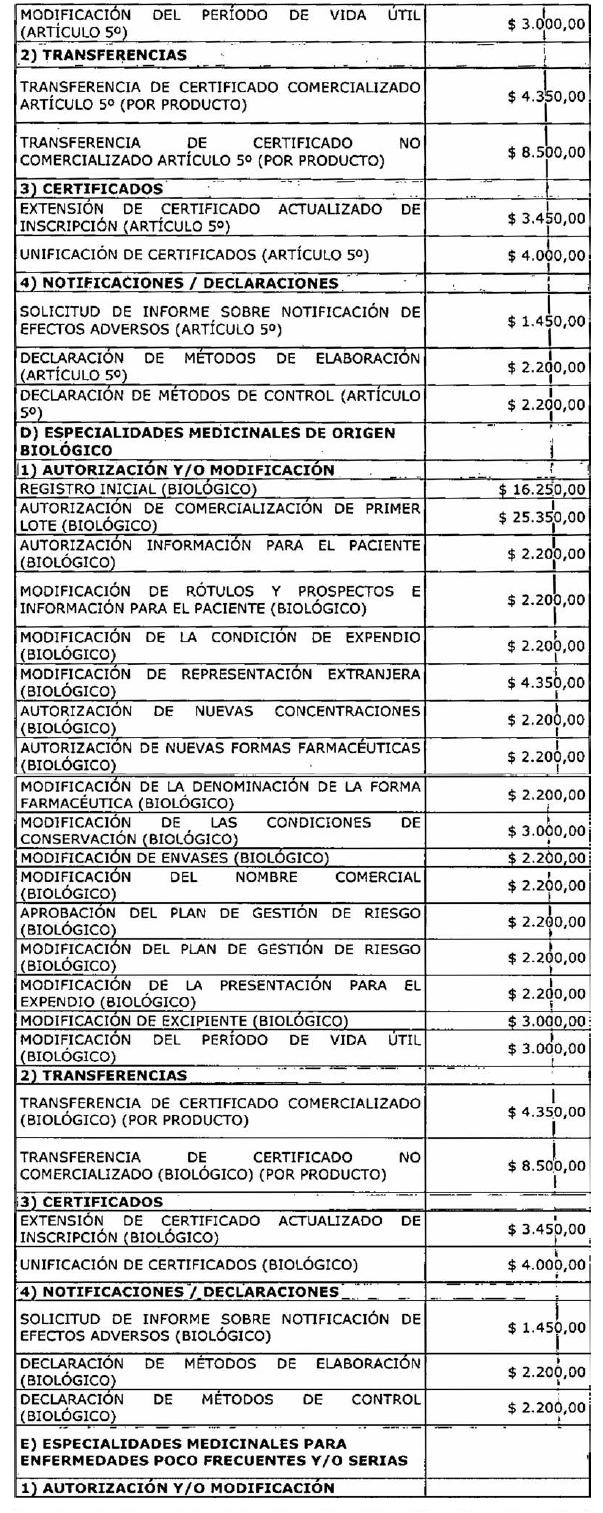
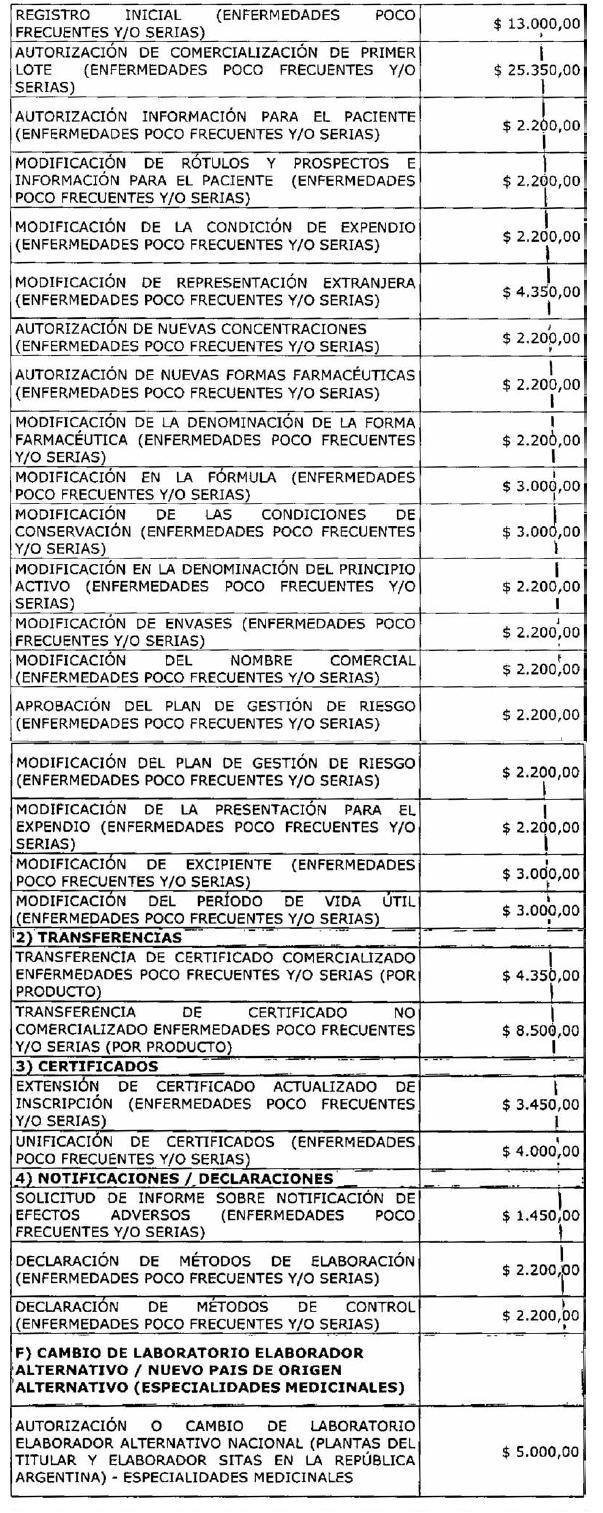
ARTÍCULO 1° — Modifícanse
los montos de los aranceles que devengarán las tramitaciones que se realicen
ante la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica
correspondientes a especialidades medicinales, medicamentos herbarios,
productos para diagnóstico de uso “in vivo”, drogas y medicamentos oficinales,
vacunas, gases medicinales, alcoholes, ingredientes farmacéuticos activos
(IFAS) de síntesis química, mezclas de nutrición parenteral extemporánea,
psicotrópicos, estupefacientes y precursores químicos, estudios de
investigación en farmacología clínica, estudios de biodisponibilidad y
bioequivalencia, sustancias de referencia, autenticaciones y constancias y/o
certificaciones de importación/exportación conforme el detalle que, como Anexo,
forma parte integrante de la presente disposición.
ARTÍCULO 2° — Establécense
los montos de los aranceles que devengarán las tramitaciones que se realicen
ante la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica
correspondientes a: testimonio de inscripción en el REM (testimonio de
exportación); cambio de categoría a medicamento herbario; autorización de
liberación de lotes; autorización información para el paciente; cambio de cepa;
cambio de tamaño de lote; habilitación nuevo laboratorio de control de calidad;
registro de establecimientos; cambio de patrocinador y/o CRO; actualización de
monografía; cronograma de presentación de los estudios de bioequivalencia
realizado en el exterior; habilitación de nueva planta elaboradora;
autorización de comercialización de primer lote; modificación de rótulos y
prospectos e información para el paciente; modificación de la condición de
expendio; autorización de nuevas concentraciones; autorización de nuevas formas
farmacéuticas; modificación de representación extranjera; modificación de la
denominación de la forma farmacéutica; modificación en la fórmula; modificación
de las condiciones de conservación; modificación en la denominación del
principio activo; modificación de envases; modificación del nombre comercial;
modificación de la presentación para el expendio; modificación de excipiente;
modificación del período de vida útil; unificación de certificados; solicitud
de informe sobre notificación de efectos adversos; habilitación como
importador; habilitación de nuevo depósito; habilitación como acondicionador;
inspección de plantas elaboradoras de productos farmacéuticos sitas en países
extranjeros; habilitación de laboratorios para la elaboración en terceros en el
país; autorización o cambio de laboratorio elaborador alternativo nacional
(plantas del titular y elaborador sitas en la República Argentina);
autorización o cambio de laboratorio elaborador alternativo extranjero (fuera
de la República Argentina); nuevo país de origen alternativo (NPOA) y
autenticación de documentos para ser presentados ante organismos oficiales;
conforme el detalle que, como Anexo, forma parte integrante de la presente
disposición.
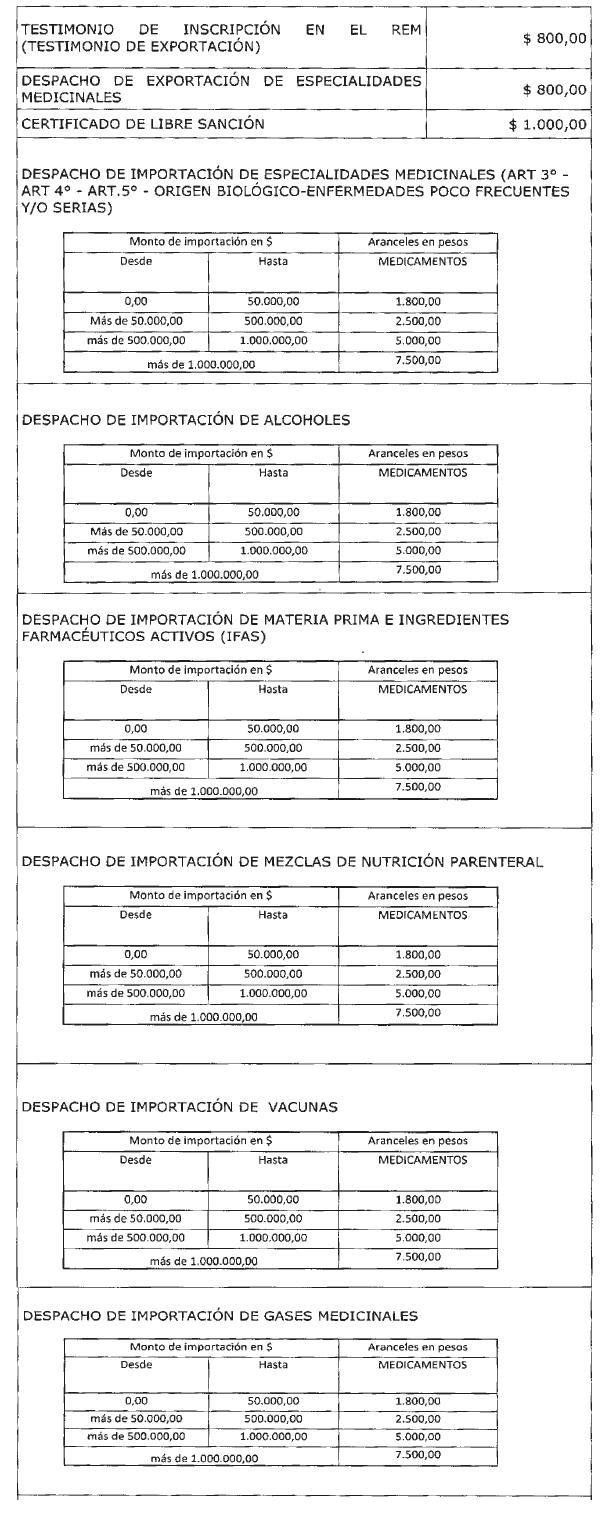
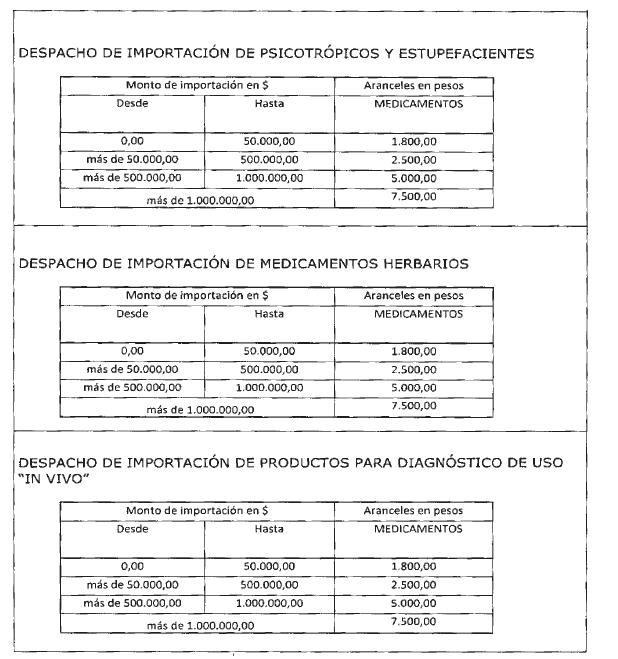
ARTÍCULO 3° — Establécese
que a los fines de determinar el “monto de importación en $”, previsto en el
apartado T) CONSTANCIAS Y/O CERTIFICACIONES DE IMPORTACIÓN/ EXPORTACIÓN, en el
ítem DESPACHO DE IMPORTACIÓN DE ESPECIALIDADES MEDICINALES (Artículo 3º –
Artículo 4° - Artículo 5° - Origen Biológico - Enfermedades Poco Frecuentes y/o
serias), en el ítem DESPACHO DE IMPORTACIÓN DE ALCOHOLES, en el ítem DESPACHO
DE IMPORTACIÓN DE MATERIA PRIMA E INGREDIENTES FARMACÉUTICOS ACTIVOS (IFAS), en
el ítem DESPACHO DE IMPORTACIÓN DE MEZCLAS DE NUTRICIÓN PARENTERAL, en el ítem
DESPACHO DE IMPORTACIÓN DE VACUNAS, en el ítem DESPACHO DE IMPORTACIÓN DE GASES
MEDICINALES, en el ítem DESPACHO DE IMPORTACIÓN DE PSICOTRÓPICOS Y
ESTUPEFACIENTES, en el ítem DESPACHO DE IMPORTACIÓN DE MEDICAMENTOS HERBARIOS y
en el ítem DESPACHO DE IMPORTACIÓN DE PRODUCTOS PARA DIAGNÓSTICO DE USO “IN
VIVO”, del Anexo de la presente disposición, deberá convertirse el valor de
facturación al tipo de cambio vendedor de la divisa según cotización del día
anterior a la fecha de pago del arancel publicada por el Banco Nación de la
República Argentina (BNA).
ARTÍCULO 4° — Derógase el
Anexo de la Disposición ANMAT N° 871/14 rectificada por Disposición ANMAT N°
7115/14.
ARTÍCULO 5° — La presente
disposición entrará en vigencia a partir del día siguiente al de su publicación
en el Boletín Oficial.
ARTÍCULO 6° — Regístrese.
Dése a la Dirección Nacional del Registro Oficial para su publicación.
Comuníquese a las Cámaras y Entidades Profesionales de los sectores
involucrados. Dése a la Dirección General del Instituto Nacional de Medicamentos,
a la Dirección de Relaciones Institucionales y Regulación Publicitaria, a la
Dirección de Gestión de Información Técnica y a la Dirección General de
Administración. Cumplido, archívese. — Ing. ROGELIO LOPEZ, Administrador
Nacional, A.N.M.A.T.
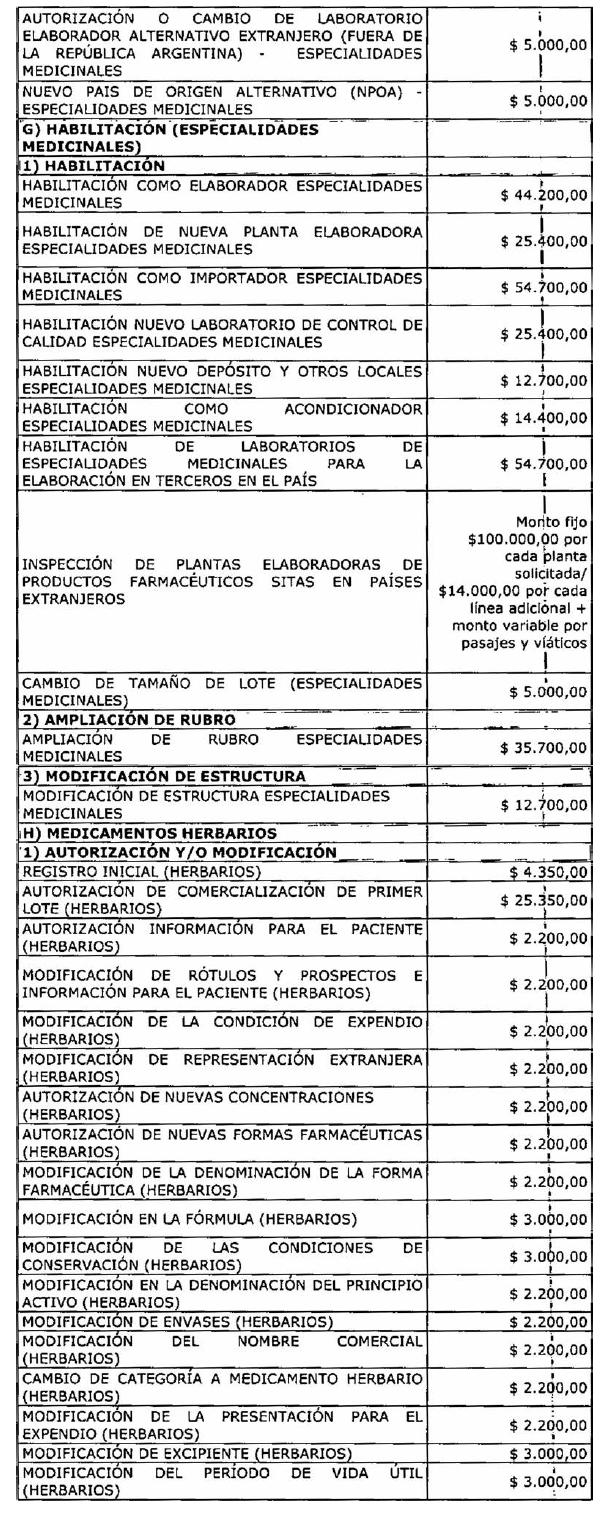
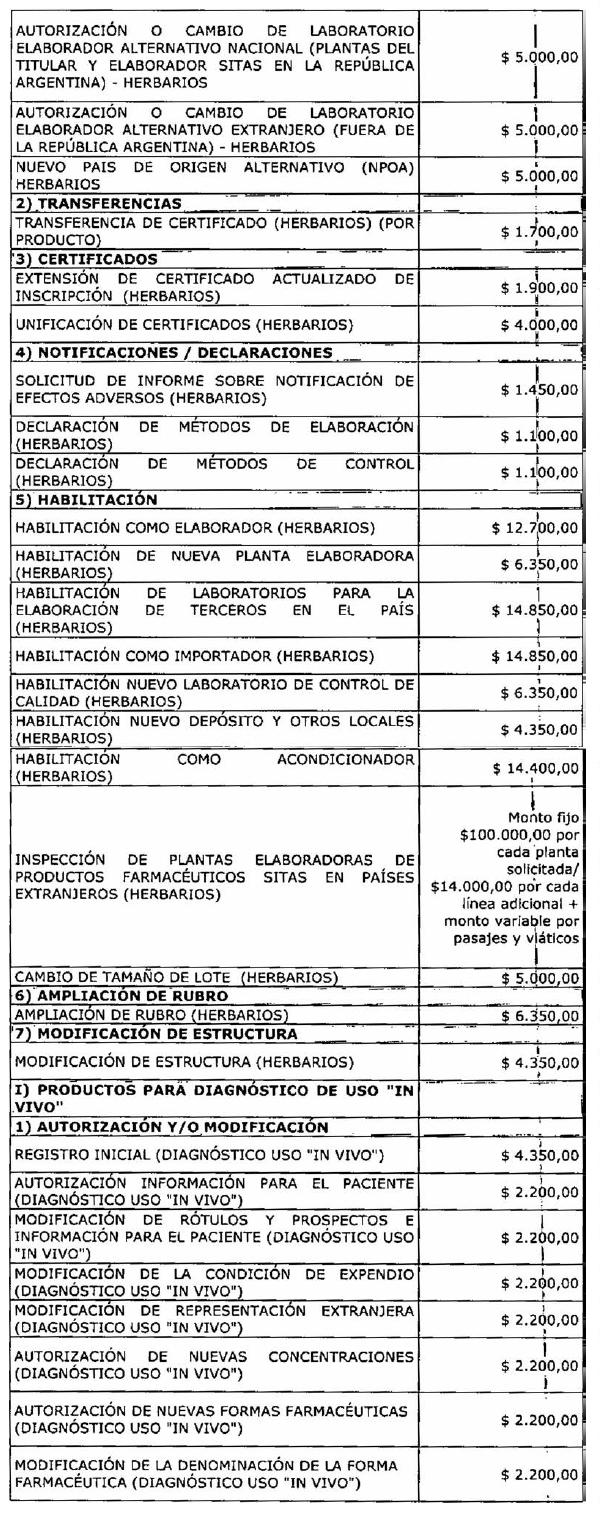
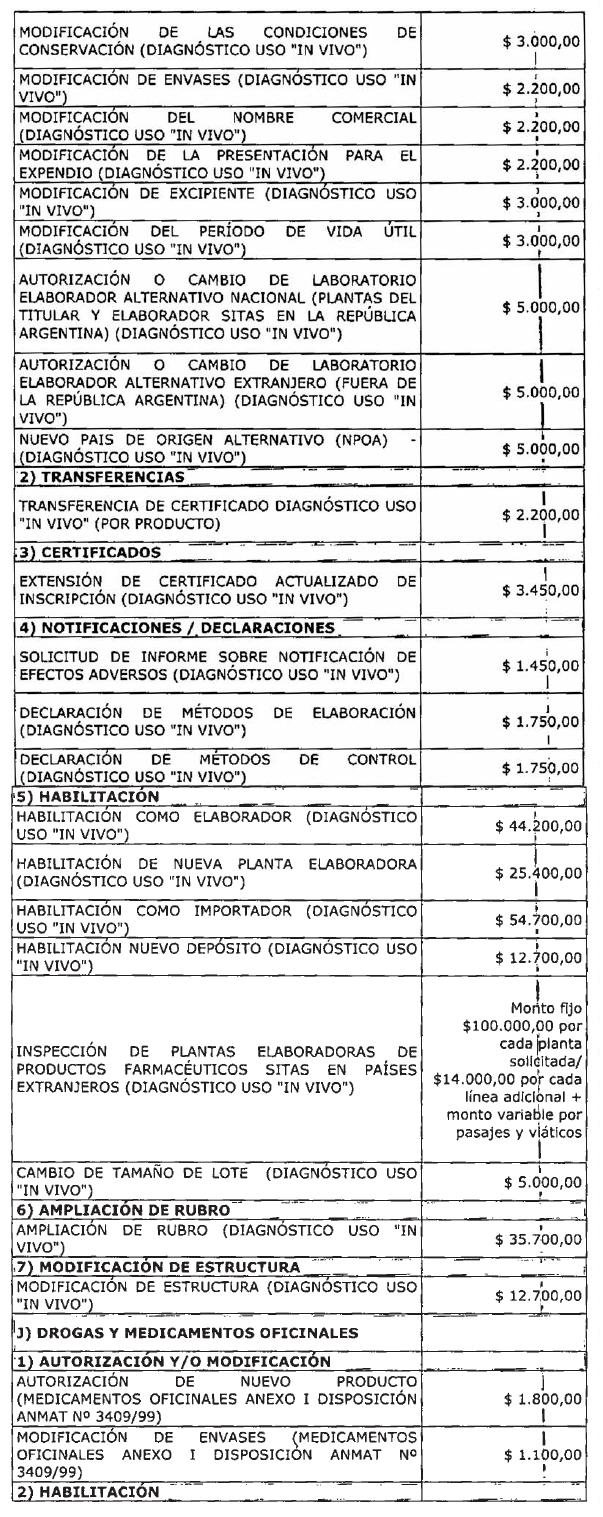
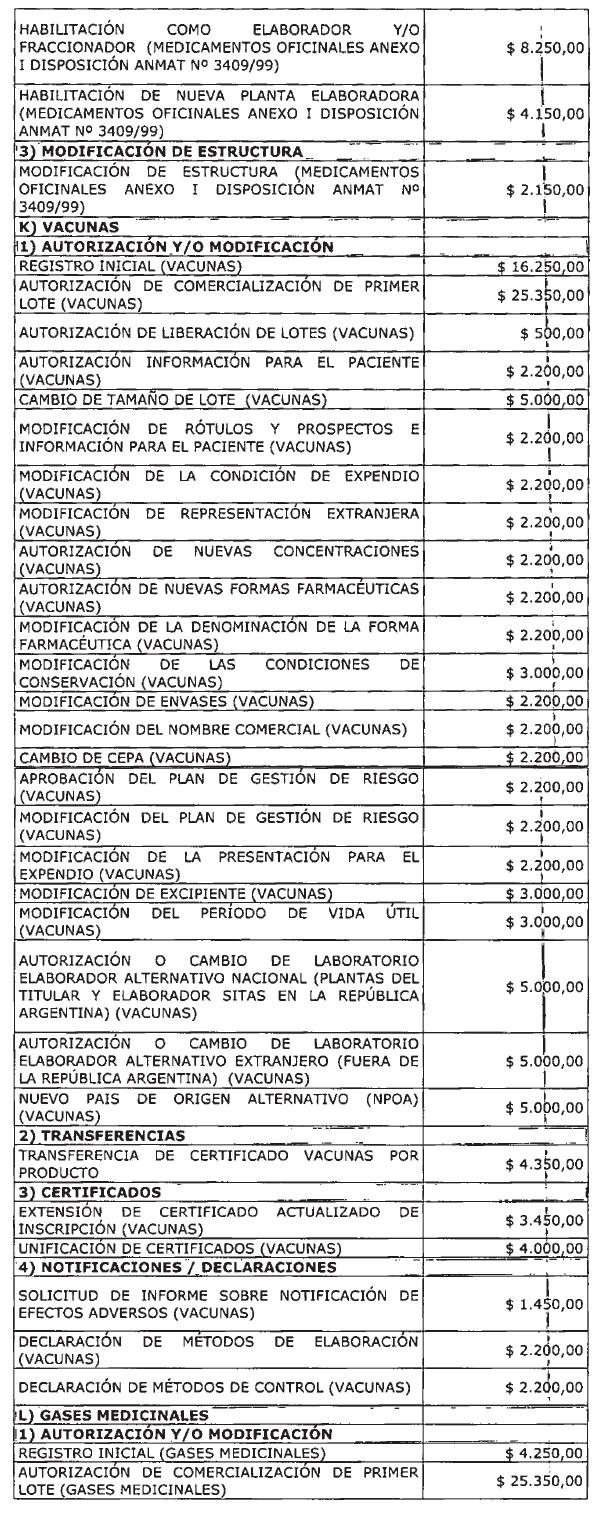
ANEXO