Disposición 872-2014
Bs. As., 31/1/2014
VISTO las Disposiciones
ANMAT N° 241/2013 y 6052/2013 y el Expediente N° 1-47-0000-014375-13-1 del
Registro de esta Administración Nacional de Medicamentos, Alimentos y
Tecnología Médica; y
CONSIDERANDO:
Que por Decreto N°
1490/92 se creó esta Administración Nacional de Medicamentos, Alimentos y
Tecnología Médica (ANMAT) como organismo descentralizado de la Administración
Pública Nacional con un régimen de autarquía económica y financiera, con
jurisdicción en todo el territorio de la Nación.
Que el aludido decreto
declaró de interés nacional las acciones dirigidas a la prevención, resguardo y
atención de la salud de la población que se desarrollen a través del control y
fiscalización de la calidad y sanidad, entre otros, de los productos,
sustancias, elementos y materiales que se consumen o utilizan en la medicina
humana, y del contralor de las actividades, procesos y tecnologías que mediaren
o estuvieren comprendidos en dichas materias.
Que asimismo el artículo
3º del referido decreto establece que esta Administración Nacional tendrá
competencia en todo lo referido al control y la fiscalización sobre la sanidad
y calidad, entre otros productos, de los reactivos, elementos de diagnóstico,
materiales y tecnología biomédicos y todo otro producto de uso y aplicación en
la medicina humana.
Que por otra el artículo
8º, inc. m) del Decreto N° 1490/92 otorga a esta Administración Nacional la
atribución de determinar y percibir los aranceles y tasas retributivas
correspondientes a los trámites y registros que se efectúen, como así también
por los servicios que se presten.
Que, por su parte, de
conformidad a lo establecido en el artículo 11 del referido cuerpo normativo,
esta Administración Nacional dispone para el desarrollo de sus acciones de los
recursos allí enumerados, entre los que se encuentran incluidos los
provenientes de las tasas y aranceles que aplique conforme a las disposiciones
adoptadas, los recargos establecidos por la mora en el pago de las tasas,
multas y aranceles que perciba y todo otro tipo de recurso que se determine a
través de las leyes y disposiciones que se establezcan con tal finalidad.
Que los montos actuales
que esta Administración Nacional percibe por los servicios que presta relación
con tales tramitaciones han devenido insuficientes para llevar a cabo de manera
eficiente las tareas correspondientes, cuya complejidad y especificidad se
incrementan con el permanente avance científico y tecnológico producido en el
sector.
Que sobre la base de las
sugerencias efectuadas por la Dirección Nacional de Productos Médicos resulta
necesario modificar la denominación de los Apartados B) Trámites
correspondientes a la Disposición N° 194/99, C) Trámites correspondientes a la
Disposición N° 2318/02 (t.o. 2004), D) Trámites correspondientes a la
Disposición N° 2319/02 (t.o. 2004), E) Trámites correspondientes a la
Disposición N° 806/07 y del ítem Autorización de funcionamiento de empresa
fabricante y/o Importadora de Productos Médicos clase III del Apartado D) punto
1 del Anexo de la Disposición ANMAT N° 241/13.
Que asimismo corresponde
la eliminación del punto 2.- Habilitaciones y el punto 3.- Certificaciones
correspondientes al Apartado A) Productos para Diagnóstico de Uso “In Vitro”
del Anexo de la citada Disposición ANMAT N° 241/13.
Que por otra parte
resulta conveniente incorporar los aranceles correspondientes a 1)
“Certificación de Cumplimiento de BPF para Empresas Radicadas en Países
Integrantes de Mercosur” con los siguientes ítems “Verificación de cumplimiento
de BPF por planta Mercosur, para productos médicos clase I”, “Verificación de
cumplimiento de BPF por planta Mercosur, para productos médicos clase II”,
“Verificación de cumplimiento de BPF por planta Mercosur, para productos médicos
clase III”, “Verificación de cumplimiento de BPF por planta Mercosur, para
productos médicos clase IV”, “Ampliación de rubro de certificado de
cumplimiento de las BPF por planta Mercosur para productos médicos clase I, II,
III y/o IV” y “Modificación de Estructura por planta Mercosur para productos
médicos clase I, II, III y IV” en el rubro correspondiente a Cumplimiento de
Buenas Prácticas de Fabricación, 2) Cambio de Domicilio Legal en los rubros
Autorización de funcionamiento de empresa (A.F.E), Productos Higiénicos,
Absorbentes y Descartables y Distribuidoras de Productos Médicos y/o Productos
para Diagnósticos de Uso in Vitro 3) Renovación de Certificado de Buenas
Prácticas de reacondicionamiento, Incorporación de Anexo de Certificado por
familia de productos clase I, Incorporación de Anexo de Certificado por familia
de productos clase II, e Incorporación de Anexo de Certificado por familia de
productos clase III en el rubro correspondiente a Productos Médicos Usados y 4)
Certificados de Libre Venta en el rubro Productos Registrados en el País.
Que finalmente resulta
conveniente proceder a la unificación de los Items Ampliación de Rubro de
certificado de Cumplimiento de las BPF (para producto médico clase I),
Ampliación de Rubro de certificado de Cumplimiento de las BPF (para producto
médico clase II), Ampliación de Rubro de certificado de Cumplimiento de las BPF
(para producto médico clase III y/o IV a partir de certificados clase I),
Ampliación de Rubro de certificado de Cumplimiento de las BPF (para producto
médico clase III y/o IV a partir de certificados clase II), Ampliación de Rubro
de certificado de Cumplimiento de las BPF (para producto médico clase III y/o
IV a partir de certificados clase III/IV) previstos en el Apartado B) punto 1
del Anexo de Disposición ANMAT N° 241/13 y de los ítems Ampliación de Rubro de
certificado de Cumplimiento de las BPF para producto médico clase I, Ampliación
de Rubro de certificado de Cumplimiento de las BPF para producto médico clase
II, Ampliación de Rubro de certificado de Cumplimiento de las BPF para producto
médico clase III, Ampliación de Rubro de certificado de Cumplimiento de las BPF
para producto médico clase VI y los ítems Modificación de Estructura para
Productos Médicos Clase I, Modificación de Estructura para Productos Médicos
Clase II, Modificación de Estructura para Productos Médicos Clase III y
Modificación de Estructura para Productos Médicos Clase IV previstos en el
Apartado B) punto 2 del Anexo de la Disposición ANMAT N° 241/13.
Que en virtud de todo lo
expuesto deviene necesario modificar los montos de los aranceles vigentes
respecto de los servicios prestados por esta Administración Nacional,
fijándolos en un valor acorde con la excelencia en la calidad que requiere la
fiscalización de las industrias involucradas.
Que la Dirección Nacional
de Productos Médicos y la Dirección General de Administración han tomado la
intervención de su competencia.
Que la Dirección General
de Asuntos Jurídicos ha tomado la intervención de su competencia.
Que se actúa en virtud de
las facultades conferidas por los Decretos N° 1490/92 y por el Decreto N°
1271/13.
Por ello,
EL ADMINISTRADOR NACIONAL
DE LA ADMINISTRACION NACIONAL DE MEDICAMENTOS, ALIMENTOS Y TECNOLOGIA MEDICA
DISPONE:
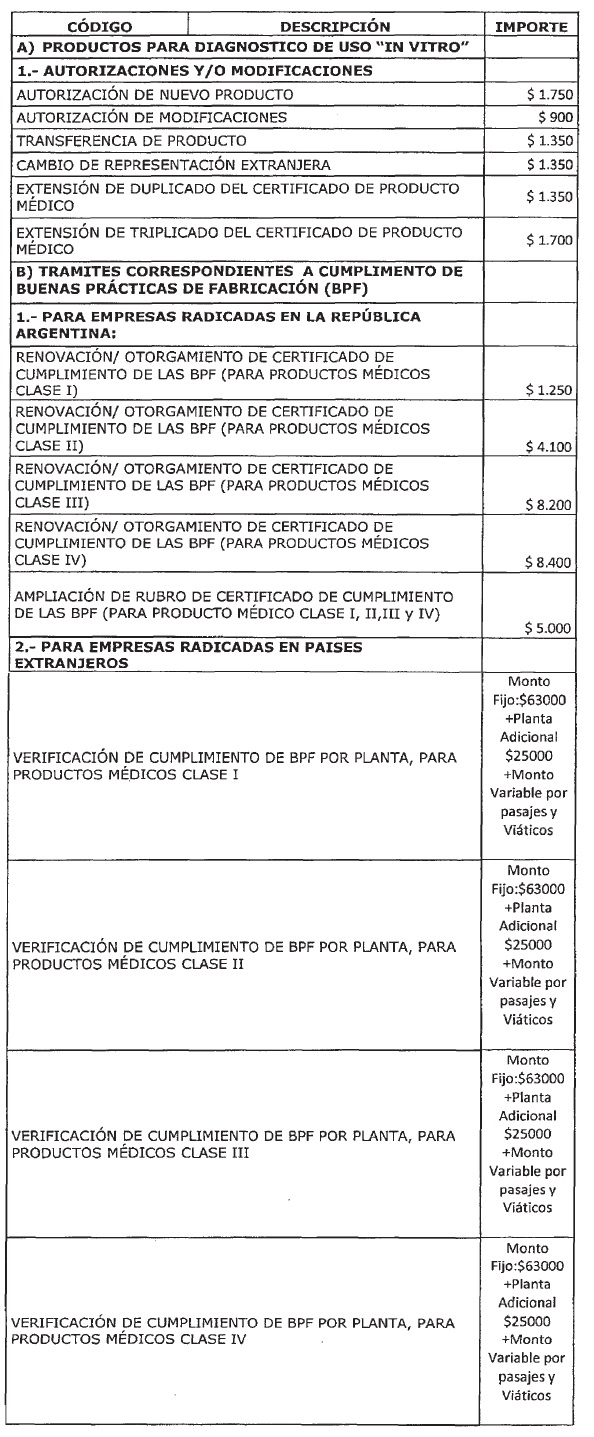
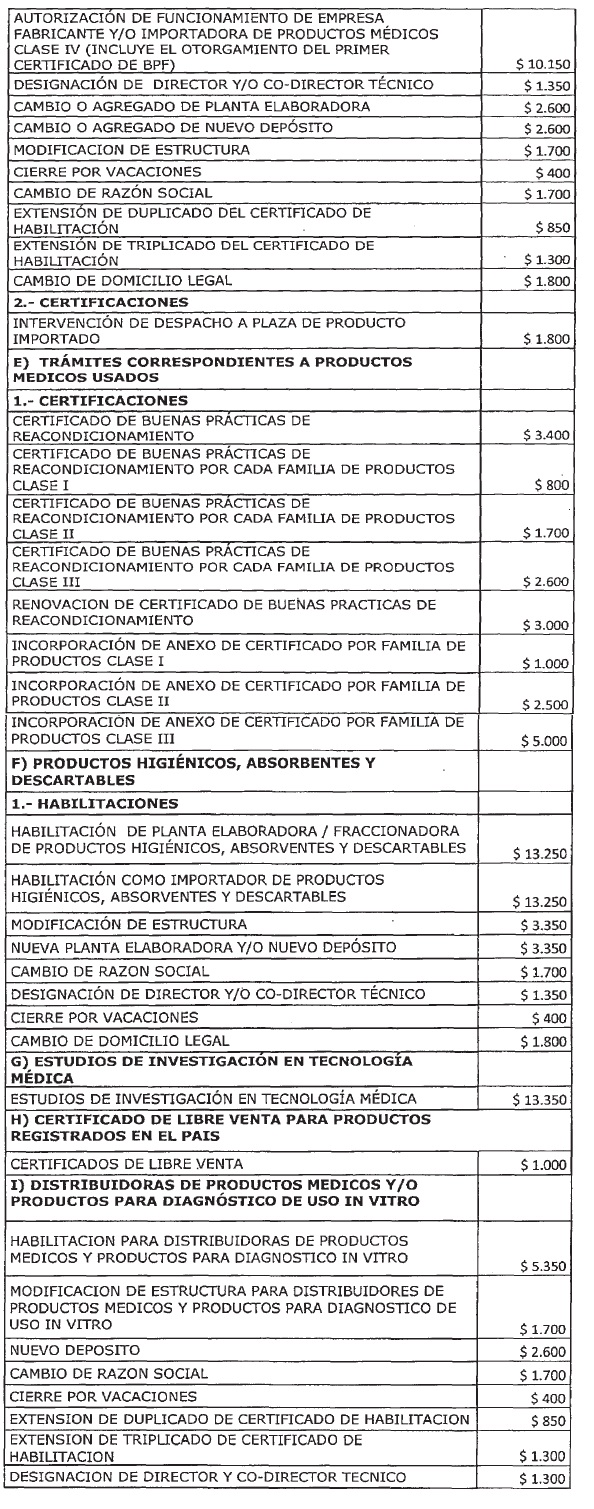
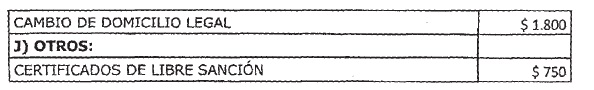
ARTICULO 1° — Modifícanse
los montos de los aranceles que devengarán las tramitaciones que se realicen
ante la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica
(ANMAT) correspondientes a los productos para diagnóstico de uso “in vitro”,
trámites correspondientes a Cumplimiento de Buenas Prácticas de Fabricación
(BPF), trámites correspondientes para la Inscripción de Productos Médicos,
trámites correspondientes a Autorización de Funcionamiento de Empresa (A.F.E),
trámites correspondientes a Productos Médicos Usados, Productos higiénicos,
absorbentes y descartables, Estudios de investigación en Tecnología Médica,
Certificado de Libre Venta para Productos Registrados en el País,
Distribuidoras de Productos Médicos y/o Productos para Diagnóstico de Uso in Vitro
y certificados de libre sanción, conforme el detalle que, como Anexo, forma
parte integrante de la presente disposición.
ARTICULO 2° —
Establécense los montos de los aranceles que devengarán las tramitaciones que
se realicen ante la Administración Nacional de Medicamentos, Alimentos y
Tecnología Médica correspondientes a: 1) Verificación de cumplimiento de BPF
por planta Mercosur, para productos médicos clase I, 2) Verificación de
cumplimiento de BPF por planta Mercosur, para productos médicos clase II, 3)
Verificación de cumplimiento de BPF por planta Mercosur, para productos médicos
clase III, 4) Verificación de cumplimiento de BPF por planta Mercosur, para
productos médicos clase IV, 5) Ampliación de rubro de certificado de
cumplimiento de las BPF por planta Mercosur para productos médicos clase I, II,
III y/o IV, 6) Modificación de Estructura para productos médicos clase I, II,
III y IV, 7) Cambio de Domicilio Legal, 8) Renovación de Certificado de buenas
prácticas de reacondicionamiento, 9) Incorporación de Anexo de Certificado por
familia de productos clase I, 10) Incorporación de Anexo de Certificado por
familia de productos clase II, 11) Incorporación de Anexo de Certificado por
familia de productos clase III y 12) Certificados de Libre Venta, conforme el
detalle que, como Anexo, forma parte integrante de la presente disposición.
ARTICULO 3° — Establécese
que los Apartados B) Trámites correspondientes a la Disposición N° 194/99, C)
Trámites correspondientes a la Disposición N° 2318/02 (t.o. 2004), D) Trámites
correspondientes a la Disposición N° 2319/02 (t.o. 2004), E) Trámites
correspondientes a la Disposición N° 806/07 y el ítem “Autorización de
funcionamiento de empresa fabricante y/o Importadora de Productos Médicos clase
III (Incluye el otorgamiento del primer certificado de BPF)” del Apartado D
punto 1 del Anexo de la Disposición ANMAT N° 241/13 se denominarán,
respectivamente: B) Trámites correspondientes a cumplimiento de Buenas
Prácticas de Fabricación (BPF), C) Trámites correspondientes para la
Inscripción de Productos Médicos, D) Trámites correspondientes a Autorización
de funcionamiento de empresa (A.F.E), E) Trámites correspondientes a Productos
Médicos Usados y “Autorización de funcionamiento de empresa fabricante y/o
Importadora de Productos Médicos clase III y Productos para Diagnóstico de Uso
in Vitro (Incluye el otorgamiento del primer certificado de BPF)”.
ARTICULO 4° — Establécese
que los ítems Ampliación de Rubro de certificado de Cumplimiento de las BPF
(para producto médico clase I), Ampliación de Rubro de certificado de
Cumplimiento de las BPF (para producto médico clase II), Ampliación de Rubro de
certificado de Cumplimiento de las BPF (para producto médico clase III y/o IV a
partir de certificados clase I), Ampliación de Rubro de certificado de
Cumplimiento de las BPF (para producto médico clase III y/o IV a partir de
certificados clase II), Ampliación de Rubro de certificado de Cumplimiento de
las BPF (para producto médico clase III y/o IV a partir de certificados clase III/IV)
previstos en el Apartado B) punto 1 del Anexo de Disposición ANMAT N° 241/13
quedan incluidos en el ítem Ampliación de Rubro de Certificado de cumplimiento
de las BPF (para producto médico clase I, II, III y IV) del apartado B punto 1
del Anexo de la presente disposición.
ARTICULO 5° — Establécese
que los ítems Ampliación de Rubro de certificado de Cumplimiento de las BPF
para producto médico clase I, Ampliación de Rubro de certificado de
Cumplimiento de las BPF para producto médico clase II, Ampliación de Rubro de
certificado de Cumplimiento de las BPF para producto médico clase III,
Ampliación de Rubro de certificado de Cumplimiento de las BPF para producto
médico clase VI y los ítems Modificación de Estructura para Productos Médicos
Clase I, Modificación de Estructura para Productos Médicos Clase II,
Modificación de Estructura para Productos Médicos Clase III y Modificación de
Estructura para Productos Médicos Clase IV previstos en el Apartado B) punto 2
del Anexo de la Disposición ANMAT N° 241/13 quedan incluidos, respectivamente,
en ítem Ampliación de Rubro de certificado de Cumplimiento de las BPF para
producto médico clase I, II, III y IV y en el ítem Modificación de Estructura
para Productos Médicos Clase I, II, III y IV del Apartado B) punto 2 del Anexo
de la presente disposición.
ARTICULO 6° — Derógase el
Anexo de la Disposición ANMAT Nº 241/13.
ARTICULO 7° — La presente
disposición entrará en vigencia a partir del día siguiente al de su publicación
en el Boletín Oficial.
ARTICULO 8° — Regístrese.
Dése a la Dirección Nacional del Registro Oficial para su publicación.
Comuníquese a las Cámaras y Entidades Profesionales; a la Dirección de
Relaciones Institucionales y Regulación Publicitaria y a la Dirección General
de Administración. Cumplido, archívese. — Dr. CARLOS CHIALE, Administrador
Nacional, A.N.M.A.T.
ANEXO
I
PRODUCTOS
MEDICOS (TECNOLOGIA MEDICA)