Disposición Nº 7667-2010
Bs.
As., 3/12/2010
VISTO
la Disposición ANMAT
Nº 7352/99 y el Expediente Nº 1-47-17750-10-1 del Registro de esta
Administración Nacional de Medicamentos, Alimentos y Tecnología Médica; y
CONSIDERANDO:
Que
la calidad microbiológica de los productos farmacéuticos no obligatoriamente
estériles contribuye a la seguridad e inocuidad de los mismos, debido a que
evidencia el cumplimiento de las Buenas Prácticas de Fabricación.
Que
estos productos pueden llegar a ser vehículo de microorganismos objetables,
tanto por ser patógenos, como por provocar alteración de productos, o ser
indicadores de calidad higiénica deficiente.
Que
su control debe cumplimentar normas establecidas por esta Administración
Nacional.
Que
en este sentido, por Disposición (ANMAT) Nº 7352/99 se establecieron los
límites microbiológicos para productos farmacéuticos no obligatoriamente
estériles, de acuerdo con la vía de administración.
Que
la experiencia acumulada a través de la aplicación de la citada norma y los
avances de la ciencia han evidenciado la necesidad de actualizar dichos
lineamientos.
Que
en consecuencia resulta necesario fijar límites de aceptabilidad para el
Control Microbiológico de productos farmacéuticos no obligatoriamente estériles
con el fin de garantizarsu inocuidad y estabilidad
desde el punto de vista microbiano, de forma tal que los mismos se encuentren
armonizados con las principales legislaciones internacionales.
Que
el Instituto Nacional de Medicamentos y la Dirección de Asuntos Jurídicos han tomado la
intervención de su competencia.
Que
se actúa en virtud de las facultades conferidas por los Decretos Nº 1490/92 y
Nº 425/2010.
Por
ello;
EL
INTERVENTOR DE LA
ADMINISTRACION NACIONAL DE MEDICAMENTOS, ALIMENTOS Y
TECNOLOGIA MEDICA
DISPONE:
ARTICULO
1º — Las empresas que elaboren y/o importen productos no obligatoriamente
estériles deberán cumplir con el Control Microbiológico de acuerdo con los
límites de aceptabilidad que se establecen por el artículo 20 de la presente
Disposición.
ARTICULO
2º — Establécense los límites microbiológicos para
productos farmacéuticos no obligatoriamente estériles de acuerdo con la vía de
administración, de conformidad con los criterios establecidos en el ANEXO I,
que forma parte integrante de la presente Disposición.
ARTICULO
3º — Las empresas que elaboren y/o importen productos farmacéuticos no
obligatoriamente estériles deberán presentar, para registro que forma parte
integrante de la presente Disposición.
ARTICULO
4º — Las empresas que elaboren y/o importen productos farmacéuticos no
obligatoriamente estériles deberán presentar, para registro de producto, de
acuerdo con los artículos 3º y 5º del Decreto Nº 150/92, la metodología
detallada del Control Microbiológico según los límites de aceptabilidad
establecidos en el artículo 2º de la presente Disposición y el Ensayo de
Efectividad del sistema conservador, cuando corresponda.
ARTICULO
5º — Derógase la Disposición (ANMAT) Nº
7352/99.
ARTICULO
6º — El incumplimiento de la presente Disposición hará pasible a los
infractores de las sanciones previstas en la Ley 16.463 y en el Decreto Nº 341/92.
ARTICULO
7º — La presente Disposición entrará en vigencia a los TREINTA (30) días
corridos, contados a partir del día siguiente al de su publicación en el
Boletín Oficial.
ARTICULO
8º — Regístrese. Comuníquese a las Cámaras y Entidades Profesionales
correspondientes y a quienes corresponda. Comuníquese al Instituto Nacional de
Medicamentos, a la Dirección
de Evaluación de Medicamentos, al Departamento de Registro y a la Dirección de
Planificación y Relaciones Institucionales, a sus efectos. Dése
a la Dirección
Nacional del Registro Oficial para su publicación. Cumplido,
archívese PERMANENTE. — Dr. CARLOS CHIALE, Interventor, A.N.M.A.T.
ANEXO
I
Tabla
I
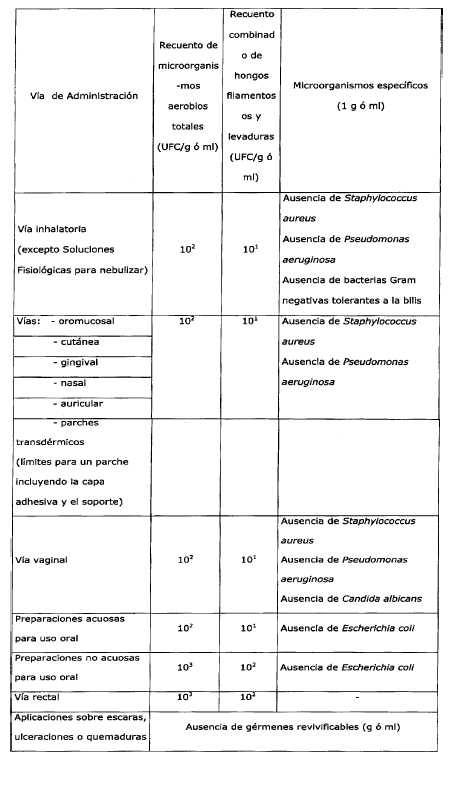
Cuando
se indica un criterio de aceptación para la calidad microbiológica, interpretar
de la siguiente manera:
-
101UFC: Significa que el recuento máximo aceptable es 20
-
102 UFC: Significa que el recuento máximo aceptable es 200
-
103 UFC: Significa que el recuento máximo aceptable es 2000; etc
En
caso de detectarse microorganismos no especificados en esta Disposición, se
deberá evaluar su relevancia en función de:
-
Vía de administración
-
Naturaleza del producto
-
Pacientes a los cuales está destinado
Para
verificar los límites establecidos en la Tabla I, se utilizarán los métodos armonizados
según el documento ICH Q4B Anexo 4C
publicados en Farmacopea Europea - Edición 6.3 -, Farmacopea Japonesa - Edición
15 - y Farmacopea de Estados Unidos de Norteamérica - Edición 30 -, a excepción
de los métodos para investigación de Presencia de gérmenes revivificables
y de Escherichia coli.
Investigación
de presencia de gérmenes revivificables
Agregar
un volumen de una dilución de la muestra equivalente a 1 g ó ml
de producto a un volumen de Caldo digerido de Caseína - Soja definido por el
proceso de validación. Incubar entre 20° C y 25° C durante al menos 5 días.
Agregar otro volumen de la misma dilución equivalente a 1 g o ml
de producto a un volumen de Medio Fluido Tioglicolato
definido por el proceso de validación. Incubar entre 30° C y 35° C durante al
menos 5 días.
La
muestra cumple con los requisitos del ensayo para ausencia de gérmenes revivificables en un gramo o mililitro si no se observa
turbidez debida a desarrollo microbiano.
Los
microorganismos adecuados para usar en la prueba de promoción del crecimiento
de los medios de cultivo y para el ensayo de validación son los descriptos en la Tabla II:
Tabla
II
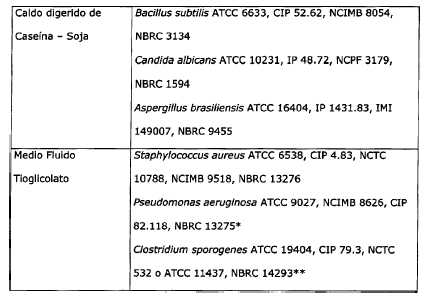
*
alternativo Kocuria
rhizophila ATCC 9341
**
alternativo Bacteroides
vulgatus ATCC 8482
Investigación
de Escherichia coli
Agregar
un volumen de una dilución de la muestra equivalente a 1 g o ml
de producto a un volumen de Caldo digerido de Caseína - Soja definido por el
proceso de validación. Incubar entre 30 y 35° C durante 18 a 24 hs.
Finalizado el período de incubación, aislar en Agar Mac Conkey. Incubar las placas
entre 30° C y 35° C durante 18
a 72 hs.
De
observarse desarrollo, confirmar mediante pruebas de identificación.