Disposición N° 7438-2010
Bs.
As., 26/11/2010
VISTO
la Ley N° 16.463, el Decreto N° 150/92,
sus modificatorios y normas complementarias, las Disposiciones (ANMAT) Nros. 2819/04 y 5743/09, y el Expediente N° 1-47-17751-10-3 del registro de esta Administración
Nacional de Alimentos, Medicamentos y Tecnología Médica; y
CONSIDERANDO:
Que
por Decreto N° 1490/92 se creó la Administración Nacional
de Medicamentos, Alimentos, y Tecnología Médica (ANMAT), como organismo
descentralizado que actúa en la órbita de la Secretaría de
Políticas, Regulación, e Institutos del Ministerio de Salud.
Que
los objetivos principales de esta Administración Nacional son el registro,
fiscalización, control y vigilancia de medicamentos, alimentos y tecnología
médica con la finalidad de garantizar a la población la eficacia (cumplimiento
del objetivo nutricional, terapéutico o de diagnóstico y tratamiento),
seguridad y calidad de los productos que la misma consume.
Que
para el cumplimiento de dichos objetivos, esta Administración Nacional ha
adoptado un modelo fiscalizador de gestión, que sin perjuicio de la lectura
objetiva de la información calificada, concentra sus esfuerzos en verificar que
los laboratorios demuestren en terreno que se encuentran en condiciones de
cumplimentar las Buenas Prácticas de Fabricación y Control.
Que
en este contexto, y ante la necesidad de garantizar la eficacia, seguridad y
calidad de los medicamentos que la población consume, se estimó procedente,
para aquellas especialidades medicinales que se registren, realizar una
verificación técnica consistente en la constatación de los métodos de control,
elaboración, ensayos de estabilidad y capacidad operativa.
Que
en función de ello se dictó la Disposición ANMAT N°
6897/00, modificada luego por su similar N° 3595/04,
derogadas ambas por la
Disposición ANMAT N° 5743/09.
Que
en esta última norma se estableció que la evaluación de la información
relacionada con los métodos de control, elaboración, ensayos farmacotécnicos, estudios de estabilidad, capacidad
operativa para elaborar y/o de control incluida en las solicitudes de
inscripción en el registro de especialidades medicinales, se realizará mediante
la verificación técnica de dicha información, en forma previa a la
comercialización, debiendo cumplimentarse los requisitos establecidos en la Disposición A.N.M.A.T. N° 2819/2004 o la que en
el futuro la reemplace y las especificaciones de calidad establecidas en la Farmacopea Argentina,
Farmacopea Brasileña y/u otra Farmacopea Internacionalmente reconocida.
Que
de conformidad con el artículo 7° de la Disposición referida, los trámites de cambio de
nombre, cambio de excipiente, transferencia de certificado, cambio de
presentación, cambio de elaborador y/o cambio de acondicionador de una
especialidad medicinal que vaya a ser sometida a un procedimiento de
verificación técnica de primer lote deberán presentarse indefectiblemente con
un plazo mínimo de sesenta (60) días corridos anteriores a la fecha de
presentación de la solicitud de verificación técnica a que se refiere el
artículo 3° de la misma.
Que
con respecto a los trámites de cambios de excipientes que menciona el citado
artículo 7°, los mismos se refieren a las variaciones de fórmula cuantitativa
producidas entre lo aprobado en el registro del producto y la composición real
del primer lote a comercializar, lo que alcanza a aquellos pequeños ajustes de
formulación que no impacten significativamente en el comportamiento de la forma
farmacéutica.
Que
en este sentido, atento la escasa repercusión que tales supuestos representan desde el punto de vista técnico a los efectos de
la verificación técnica contemplada en la norma, se estima apropiado eximir a
los mismos de la presentación anticipada prevista en el artículo 7°.
Que
a tales fines resulta necesario determinar los parámetros técnicos respecto de
los cuales los cambios de excipientes no impactan significativamente en el
comportamiento de la forma farmacéutica del producto a verificar.
Que
el Instituto Nacional de Medicamentos, y la Dirección de Asuntos
Jurídicos han tomado la intervención de su competencia.
Que
se actúa en ejercicio de las facultades conferidas por los Decretos Nros. 1490/92 y 425/10.
Por
ello;
EL
INTERVENTOR DE LA
ADMINISTRACION NACIONAL DE MEDICAMENTOS, ALIMENTOS Y
TECNOLOGIA MEDICA
DISPONE:
ARTICULO
1° — Establécese que podrán eximirse de la
presentación anticipada prevista en el artículo 7° de la Disposición (ANMAT) N° 5743/09 aquellos cambios de excipientes que representen
pequeños ajustes de formulación entre lo aprobado en el registro del producto y
la composición real del primer lote a comercializar que no impacten
significativamente en el comportamiento de la forma farmacéutica del producto,
de acuerdo a lo que se establece en el artículo 2° de la presente.
ARTICULO
2° — La eximición prevista en el artículo inmediato
precedente, únicamente será procedente siempre que se cumplan los siguientes
requisitos:
a)
Que la solicitud de verificación técnica de primer lote prevista en la Disposición (ANMAT) N° 5743/2009 sea acompañada de una declaración de las
fórmulas aceptadas y propuestas con indicación de categoría funcional de sus
excipientes y porcentaje de cambio.
b)
Que dicha variación se encuentre dentro de los parámetros técnicos establecidos
en el listado que como ANEXO I forma parte integrante de la presente
Disposición.
c)
Que el cambio de excipiente no implique cambios en la metodología analítica
aprobada (más allá del ajuste de peso).
d)
Que con la solicitud de verificación técnica de primer lote prevista en la Disposición (ANMAT) N° 5743/2009 se acompañe prospecto del producto con la
fórmula actualizada.
e)
Que para el caso de formas farmacéuticas sólidas orales de liberación inmediata
o modificada, el laboratorio acredite el cumplimiento del ensayo de disolución
aprobado en el trámite de autorización del producto, y pueda demostrar
equivalencia in Vitro con el similar presentado en el Registro del producto,
con eventual verificación durante la inspección de Primer Lote.
ARTICULO
3° — La presente Disposición entrará en vigencia a partir del día siguiente al
de su publicación en el Boletín Oficial.
ARTICULO
4° — Regístrese. Comuníquese a las Cámaras de los sectores involucrados en la
medida adoptada en la presente disposición. Dése a la Dirección Nacional
del Registro Oficial para su publicación. Comuníquese al Instituto Nacional de
Medicamentos (INAME), al Departamento de Registro y a la Dirección de
Planificación y Relaciones Institucionales. Cumplido, archívese PERMANENTE. —
Dr. CARLOS CHIALE, Interventor, A.N.M.A.T.
ANEXO
I
A.
FORMULACIONES SOLIDAS DE LIBERACION INMEDIATA
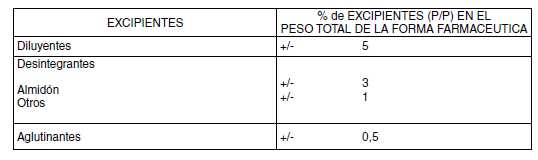
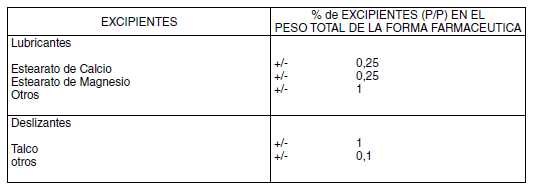
A.1.
Cambio en la cantidad de los excipientes autorizados dentro de los límites
establecidos en la siguiente tabla:
A.2.
Cubierta: Cambio de % de aplicación +/- 10 %
A.3.
Eliminación o ajuste del color o saborizantes o
edulcorantes.
A.4.
Cambio en la calidad técnica del diluyente.
B.
FORMULACIONES SOLIDAS DE LIBERACION MODIFICADA
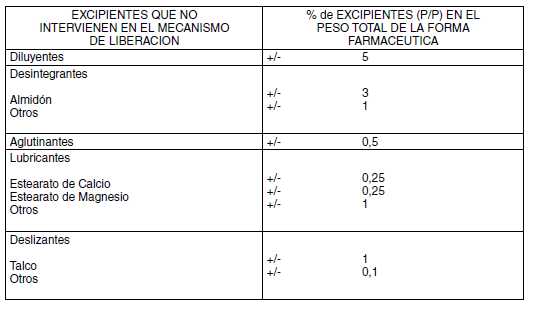
B.1.
Cambio en la cantidad de los excipientes autorizados dentro de los límites
establecidos en la siguiente tabla:
B.2.
Cubierta NO FUNCIONAL (NO INTERVIENE EN LA LIBERACION): Cambio de
porcentaje de aplicación: +/- 10 %.
B.3.
Eliminación o ajuste del color o saborizantes o
edulcorante.
B.4.
Cambio en la calidad técnica del diluyente.
C.
FORMULACIONES LIQUIDAS ORALES
C.1.
Eliminación total o parcial del componente cuya única función es afectar el
color o sabor de la formulación.
C.2.
Ajustes en la cantidad de agente viscosante: cambio
en su porcentaje dentro de +/- 5 %.
D.
FORMULACIONES LIQUIDAS / SEMISOLIDAS DE USO TOPICO
D.1.
Eliminación total, parcial o ajuste del componente cuya única función es
afectar el color, sabor o aroma de la formulación.
D.2.
Modificación en la cantidad de agente viscosante:
cambio en su porcentaje dentro de +/- 5 %.
E.
FORMULACIONES OFTALMICAS
E.1.
Ajuste en las sales de Osmolaridad: Cambio en su
porcentaje dentro de +/- 5 %.
E.2.
Ajuste de sales para pH: Cambio en su porcentaje
dentro de límites +/- 5 %.
E.3.
Ajuste en la cantidad de agente viscosante: Cambio en
su porcentaje dentro de límites +/- 2 %.
F.
FORMULACIONES LIQUIDAS ESTERILES
F.1.
Ajuste de sales para Osmolaridad: cambio en su
porcentaje dentro de límites +/- 5 %.
F.2.
Ajuste de sales para pH: cambio en su porcentaje
dentro de límites +/- 5 %.